
Rycina 6. Po zlokalizowaniu nacieków nowotworowych w marginesach (bocznym i/lub głębokim) chirurg podejmuje decyzję o zakresie poszerzenia wycięcia w ściśle określonych miejscach i zaznacza je na rysunku „mapy guza” – tutaj zieloną linią

Rycina 7. Preparat histopatologiczny z drugiego etapu wycięcia, w którym po raz kolejny wykazano i zlokalizowano nacieki nowotworowe
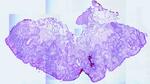
Rycina 8. Preparat histopatologiczny z piątego etapu wycięcia, w którym nie wykazano obecności nacieków nowotworowych, w związku z czym resekcję guza uznano za radykalną
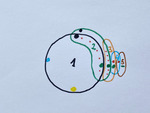
Rycina 9. „Mapa guza” po pięciu etapach wycięcia. Margines ostatniego (piątego) wycięcia nie zawiera tkanki nowotworowej i jest zaznaczany zielonym minusem
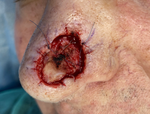
Rycina 10. Ubytek tkanek po pięciu etapach wycięcia, z marginesami wolnymi od nacieków nowotworu – nadający się do rekonstrukcji chirurgicznej. Niezależnie od liczby etapów wycięcia i czasu ich trwania najczęściej jest ona wykonywana jeszcze tego samego dnia
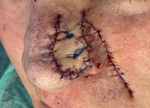
Rycina 11. Stan bezpośrednio po zakończeniu rekonstrukcji z zastosowaniem płata skórno-tłuszczowego transponowanego z lewego fałdu nosowo-wargowego
Do leczenia kwalifikowani są wyłącznie pacjenci z potwierdzonymi histopatologicznie nowotworami złośliwymi skóry. Leczenie w ośrodkach prowadzonych przez autora przebiega aktualnie w następujący sposób:
- Wykonywane jest cyfrowe zdjęcie makrofotograficzne guza z oznaczonymi markerem: widocznymi granicami guza (linią przerywaną), granicami pierwszego wycięcia (linią ciągłą) oraz punktami orientacyjnymi na obwodzie (głównym na godzinie 12 – zaznaczonym parafką, pozostałymi – zaznaczonymi krótkimi kreskami) (ryc. 1).
- Na karcie leczenia nowotworu rysowana jest odręcznie figura odpowiadająca kształtowi planowanego pierwszego wycięcia wraz z punktami orientacyjnymi obwodu zaznaczanymi schematycznymi kolorami. Rysunek ten będzie stanowił podstawę uzupełnianej sukcesywnie w kolejnych krokach ilustracji położenia nacieków nowotworu, tzw. mapy guza (ryc. 2).
- W znieczuleniu miejscowym wykonywana jest biopsja guza (ścinająca, nacinająca lub wycinająca), stosunkowo płytko, bez penetracji tkanki podskórnej. Co prawda rozpoznanie nowotworu zostało już wcześniej potwierdzone histologicznie, niemniej biopsja pozwala na zapoznanie się z architekturą guza, co jest pomocne w ocenie marginesów wycięcia.
- Bezpośrednio po niej wykonywane jest wycięcie z planowanym uprzednio wstępnym niewielkim marginesem. Skóra przecinana jest nieco skośnie, dno – poprzecznie na poziomie tkanki podskórnej. Zarówno na preparacie chirurgicznym, jak i na otaczającej skórze zaznaczane są ustalone wcześniej punkty orientacyjne obwodu: nacięciem podwójnym (punkt główny) oraz nacięciami pojedynczymi (punkty pozostałe). Można także stosować dodatkowe zaznaczanie niektórych punktów szwami chirurgicznymi.
- Preparaty tkankowe z biopsji i z pierwszego etapu wycięcia są układane na papierowej podkładce i zanoszone do laboratorium, gdzie pracę przejmuje technik. Jednak operator, jako osoba znająca najlepiej strukturę preparatu chirurgicznego, powinien poinformować go o szczegółach dotyczących tego preparatu. Następnie technik identyfikuje nacięcia na jego brzegach i zabarwia je podobnie jak na odręcznym schemacie wycięcia (tzw. kodowanie barwnikami – color coding). Kolory te powinny być widoczne na preparatach histologicznych. Technik decyduje ponadto, czy preparat można opracować w jednym fragmencie, czy w kilku (skrawki muszą zmieścić się na standardowym szkiełku podstawowym). W tym drugim przypadku dzieli preparat skalpelem na części i zaznacza dodatkowo barwnikami ich przekroje, a ewentualne podziały tkanki oraz barwienia odręcznie rysuje na „mapie guza”. Następnie technik prostuje preparat tkankowy tak, by marginesy chirurgiczne boczne i z dna znajdowały się w jednej płaszczyźnie, utrwala je w tym kształcie poprzez zamrażanie, zatapia na stoliku w żelu OCT, sporządza bloczek tkankowy, skraja tkankę w mikrotomie kriostatu na skrawki o grubości 8-10 mikrometrów, pobiera je na szkiełka podstawowe, suszy, barwi szybkim szeregiem metodą HE (najlepiej w barwiarce), pokrywa szkiełkami nakrywkowymi, skanuje preparaty histologiczne przy użyciu skanera (obecnie skanera manualnego PathoCam CancerCenter.ai), przekazuje je za pośrednictwem internetu na platformę diagnostyczną do telepatologii (obecnie PathoViewer CancerCenter.ai), po czym informuje o tym lekarza operującego (ryc. 3, 4).
- Lekarz operujący analizuje preparaty histologiczne (pod mikroskopem lub na monitorze komputera), wprowadza do aplikacji PathoViewer CancerCenter.ai swoje uwagi (tekstowe i graficzne, np. obrysowuje na skanie preparatu miejsca stwierdzonych nacieków nowotworu) i informuje patologa o potrzebie przeprowadzenia badania histopatologicznego. Współpracujący patolog, dzięki szybkiemu połączeniu z internetem, analizuje na bieżąco preparaty niezależnie od aktualnego miejsca pobytu. Ważne jest jednak, by chirurg umiał podjąć z nim dyskusję na temat obrazu histopatologicznego, np. nacieków fałszywie dodatnich czy też mankamentów technicznych danego preparatu. Po ustaleniu rozpoznania przez patologa (braku nacieków nowotworowych lub ich lokalizacji) – informacje o nim (tekstowe i/lub graficzne) są wprowadzane do programu (ryc. 4). Dane te są następnie odręcznie wrysowywane przez chirurga na papierową „mapę guza” (ryc. 5). Dalej leczenie może przebiegać w różny sposób.
- Jeśli w marginesie chirurgicznym nie stwierdzono obecności nacieków nowotworowych – pacjent podlega zabiegowi rekonstrukcyjnemu wykonywanemu przez chirurga. Jeżeli zaś wykazano w marginesie nacieki nowotworu – to dzięki możliwości ich dokładnej lokalizacji pacjent jest poddawany ich sukcesywnemu wybiórczemu wycięciu (ryc. 6). Po docięciu marginesów kolejne preparaty tkankowe są opracowywane w podobny sposób (wg punktów 2-6) i ponownie badane histopatologicznie (ryc. 7). W celu dojścia do marginesów wolnych od nacieków nowotworowych często konieczne jest ich wielokrotne sukcesywne docinanie (ryc. 8). Wszystkie zdiagnozowane w marginesach tkanki nowotworowe oraz marginesy poszczególnych etapów wycięcia są rysowane ręcznie, krok po kroku, na „mapie guza” (ryc. 9).
- Zamknięcie ubytku (rekonstrukcja) jest wykonywana po osiągnięciu marginesów wolnych od nacieków nowotworu (ryc. 10, 11).
Kształtowanie, bloczkowanie i skrajanie tkanek
Najważniejszym elementem technicznym w CMM jest kształtowanie tkanek i ich zatapianie w bloczku. Prawidłowe wykonanie tych czynności stanowi warunek pobrania skrawków horyzontalnych (typu en face) z powierzchni odpowiadającej marginesowi chirurgicznemu. Jest to możliwe tylko wówczas, gdy nierówna powierzchnia marginesu chirurgicznego ulegnie przekształceniu w równą płaszczyznę (wyprostowaniu) oraz gdy nóż kriostatu porusza się równolegle do powierzchni bloczka tkankowego. Nie jest to łatwe, a początkowo można spodziewać się dużych trudności w wykonywaniu takich skrawków.
Najczęściej stosowaną metodę bloczkowania stanowi metoda bezpośrednia. Wymaga ona jedynie umiejętnego wykorzystania kriostatu i polega na spłaszczeniu i zamrożeniu tkanek w kriostacie za pomocą ewakuatora ciepła. Metoda ta wiąże się jednak z koniecznością posiadania ogromnego doświadczenia przez techników histologicznych oraz jest stosunkowo niedokładna10,11.
Wykorzystanie dodatkowych narzędzi/urządzeń pozwala na łatwiejsze i dokładniejsze bloczkowanie10,11,16. Autor stosuje rutynowo urządzenie B-S, opracowane przez siebie i dr. inż. Janusza Szymkowskiego17. Umożliwia ono uzyskanie dużych skrawków z najbardziej powierzchownych warstw bloczka tkankowego. Bloczkowanie tkanek może być wykonywane nawet przez mało doświadczonych techników, ponieważ polega na przeprowadzeniu dokładnie zdefiniowanych czynności. Zastosowanie tej techniki wymagało jednak wieloletnich prób, inwestycji, wygospodarowania miejsca w laboratorium i zorganizowania systematycznego zaopatrzenia w azot.
Ograniczenia w upowszechnieniu chirurgii mikrograficznej Mohsa
W Stanach Zjednoczonych CMM zyskała kluczowe miejsce wśród metod leczenia nowotworów skóry. Także w innych krajach podejmowano liczne próby jej wdrożenia i upowszechnienia. Na przeszkodzie stawało jednak przekonanie, że leczenie to jest trudne ze względu na konieczność spełnienia wielu wymogów. Niezbędne jest przede wszystkim posiadanie przez lekarza prowadzącego ośrodek rzadkich kompetencji (znajomość techniki i diagnostyki histologicznej, a także chirurgii onkologicznej skóry, w tym – chirurgii rekonstrukcyjnej). W USA konieczny jest również tytuł chirurga Mohsa, przyznawany głównie dermatologom przez American College of Mohs Micrographic Surgery and Cutaneous Oncology oraz American Society for Mohs Surgery po odbyciu rocznego szkolenia w certyfikowanych ośrodkach. Konieczne są również wysokie kompetencje technika – umiejącego wykonać bardzo precyzyjne i rozległe preparaty histologiczne horyzontalne typu en face. Nie mniej istotne jest rozplanowanie pomieszczeń ośrodka zajmującego się CMM – z pracownią histologiczną skrawków mrożeniowych zlokalizowaną w bezpośredniej bliskości sal zabiegowych oraz miejscem zapewniającym wygodne oczekiwanie pacjentów na kolejne etapy zabiegu. Konieczne jest też poświęcenie całego czasu pracy personelu oraz używanych urządzeń wyłącznie tej formie leczenia. Opisany powyżej system pracy – stosowany rutynowo w USA – może być trudny do wdrożenia w innych krajach18.
W związku z tym poza Stanami Zjednoczonymi wprowadzano podobne, ale uproszczone formy leczenia, analogiczne do chirurgii mikrograficznej. Takim zabiegom nadano nazwę PDEMA (peripheral and deep en face margin assessment) lub wycięcia chirurgicznego sterowanego histologicznie (histologically guided surgical excision)5,8,9,19. Podejmowano np. podobne zabiegi oparte na standardowej preparatyce formalinowo-parafinowej (metoda 3D lub slow Mohs) z wykorzystaniem zwykłej szpitalnej pracowni histopatologicznej19-21. Stosowano uproszczoną technikę skrawków mrożeniowych, bazując na wyposażeniu i personelu szpitalnych pracowni do badań śródoperacyjnych21. W przypadku konieczności współpracy z patologiem – opracowywano różne formy szybkiej z nim komunikacji19,20,22-24.
Zdaniem autora, który jedną z metod PDEMA stosował w latach 1994-1999, CMM w odmianie tkanki świeżej jest jednak dużo korzystniejsza. Decydują o tym znacznie szybszy proces leczenia (trwający kilka czy kilkanaście godzin, a nie dni lub tygodni) oraz mniejsze ryzyko błędów technicznych i interpretacyjnych.
CMM może być jednak niełatwa do pogodzenia z trybem pracy dużego szpitala, choćby ze względu na trudny do przewidzenia czas pracy (znacznie dłuższy niż przy standardowym wycięciu nowotworu) bądź konieczność zrealizowania zazwyczaj napiętego planu operacyjnego. Najłatwiej prowadzić leczenie tą metodą w małych ośrodkach, wyspecjalizowanych wyłącznie w terapii nowotworów skóry.
Perspektywy chirurgii mikrograficznej Mohsa
Umiejętnością stosowania metody Mohsa wykazują się przede wszystkim dermatolodzy, jednak wiedza o niej przeniknęła także do szerszego grona lekarzy. Obecnie gremia specjalistów w zakresie różnych dyscyplin (chirurgii onkologicznej, chirurgii głowy i szyi, chirurgii szczękowo-twarzowej, dermatologii i innych) zalecają CMM jako wzorcową metodę leczenia nowotworów skóry, szczególnie raków podstawnokomórkowych z grupy wysokiego ryzyka agresji i/lub nawrotu3,5,25.
Zdaniem autorów jej dalsze upowszechnienie jest możliwe pod warunkiem ścisłego zaangażowania patologów do zespołów leczących. Konieczne jest stworzenie warunków umożliwiających im udział w diagnostyce histopatologicznej w chirurgii Mohsa „na żądanie”. Biorąc pod uwagę małą liczbę specjalistów w tej dziedzinie i ich znaczne obłożenie pracą – kluczową rolę mogą odgrywać oszczędzające czas techniki telepatologiczne. Należy jednak dążyć do ich dostosowywania do wymogów CMM. Konieczny jest ich dalszy rozwój, szczególnie w aspekcie usprawnień cyfrowego „mapowania nowotworu”, służącego dalszej poprawie korelacji pomiędzy obrazem klinicznym i histopatologicznym.