Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 23:59! Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Zespół przetoczenia między płodami – modyfikacja postępowania
Małgorzata Świątkowska-Freund, Krzysztof Preis
Wprowadzenie
Zespół przetoczenia między płodami jest schorzeniem występującym z częstością około 1:2500 urodzeń. Mimo że jest to stosunkowo rzadko spotykana choroba, budzi duże zainteresowanie położników ze względu na ogromny wpływ terapii wewnątrzmacicznej na przeżywalność płodów. Zastosowanie fetoskopii pozwoliło u kobiet, u których szanse na przeżycie płodu ocenia się na 0-20%, uzyskać przeżycie przynajmniej jednego dziecka u ponad 80%. W poniższym artykule przedstawione zostały aktualne zasady postępowania, nowa klasyfikacja umożliwiająca ocenę rokowania w zależności od zaawansowania choroby oraz ostatnia modyfikacja techniki operacyjnej.
Patogeneza
Patogeneza zespołu przetoczenia między płodami (twin-to-twin transfusion syndrome, TTTS) nie jest do końca jasna. Wiadomo, że jego występowanie jest uwarunkowane istnieniem połączeń naczyniowych między płodami we wspólnym łożysku.1 Takie połączenia występują w ponad 95% łożysk z ciąż bliźniaczych jednokosmówkowych2 i nie wiadomo, dlaczego w niektórych ciążach przepływ w nich przez całe dziewięć miesięcy jest zrównoważony, a w niektórych w pewnym momencie dochodzi do zaburzenia tej równowagi. Znaleziono pewną korelację między lokalizacją przyczepów łożyskowych pępowin a skłonnością do pojawienia się TTTS – niesymetryczne przyczepy, czyli jeden pośrodkowy, a drugi brzeżny czy błoniasty, sprzyjają wystąpieniu zespołu.3,4 Podobnie niejasna jest dynamika i kolejność zmian w przebiegu choroby. U niektórych pacjentek przebieg jest bardzo gwałtowny, a u niektórych zdarza się nawet, że zaobserwowane zmiany się cofają.
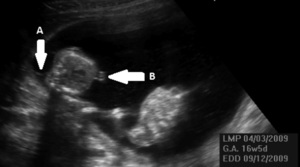
Pierwszym efektem zaburzenia równowagi przepływu krwi między płodami jest zmiana objętości krwi krążącej u obu płodów. Jeden z nich staje się hipowolemiczny i nazywany jest dawcą, a drugi hiperwolemiczny jest biorcą (ryc. 1).
U dawcy hipowolemia powoduje zmniejszenie diurezy, które w badaniu ultrasonograficznym (USG) początkowo objawia się małowodziem, czyli zmniejszeniem się maksymalnej kieszeni płynowej (maximal vertical pocket, MVP) do 2 cm lub mniej. W skrajnej postaci oligurii, czyli anurii, w USG przestaje być widoczny mocz w pęcherzu moczowym płodu, a małowodzie staje się bezwodziem. Zmniejszenie objętości krwi krążącej płód próbuje wyrównać pobieraniem płynu przez łożysko od matki (co w rezultacie daje niedokrwistość i przyspieszenie przepływu skurczowego w tętnicy środkowej mózgu) oraz zwiększeniem oporu obwodowego, czyli wzrostem wskaźników oporu i pulsacji w tętnicy pępowinowej. Skrajna hipowolemia i niedokrwistość prowadzą do niedotlenienia płodu ujawniającego się obrzękiem uogólnionym, a w ostateczności do jego zgonu.5-7
Mechanizmy kompensacyjne uruchamiane przez biorcę w celu wyrównania nadmiernej objętości krwi krążącej początkowo ograniczają się do poliurii i zwiększania się objętości płynu owodniowego. Górna granica normy MVP jest określona przez wszystkich autorów jako 8 cm, jeśli wiek ciążowy nie przekracza 20 tygodni. Natomiast w ciąży starszej niektórzy autorzy zalecają utrzymanie tej granicy na poziomie 8 cm, inni natomiast sugerują jej przesunięcie do 10 cm.5-7
Pozbywanie się płynnych składników krwi przez biorcę prowadzi do policytemii i zmniejszenia maksymalnej prędkości skurczowej w tętnicy środkowej mózgu. Kiedy mechanizmy kompensacyjne przestają być wydolne, zaczynają być widoczne cechy objętościowego przeciążenia serca płodu. Przepływ zwrotny przez zastawkę trójdzielną, nieobecna lub wsteczna fala „a” w przewodzie żylnym oraz pulsacja w żyle pępowinowej sugerują zaawansowane zmiany w krążeniu biorcy. Prowadzą one do obrzęku uogólnionego, który u biorców występuje częściej niż u dawców, oraz do zgonu płodu.7
Diagnostyka i klasyfikacja
Współczesna diagnostyka TTTS opiera się na ultrasonograficznej ocenie objętości płynu owodniowego. Nie można ustalić rozpoznania zespołu przetoczenia między płodami, jeśli w pierwszej połowie ciąży, a najlepiej w I trymestrze ciąży, nie została określona kosmówkowość. Wspólna kosmówka jest warunkiem wystąpienia TTTS, a w sytuacji skrajnego małowodzia, czy wręcz bezwodzia, określenie kosmówkowości nie jest możliwe. W ciąży jednokosmówkowej, przy MVP jednego płodu ≤2 cm i drugiego płodu ≥8 cm (10 cm), ustalane jest rozpoznanie TTTS.5, 7
Obserwowane w badaniu USG inne, opisane powyżej, cechy TTTS nie warunkują rozpoznania choroby, a jedynie świadczą o jej zaawansowaniu. Najbardziej popularną skalę określającą zaawansowanie TTTS przedstawioną przez Quintero w 1999 roku i nadal najchętniej stosowaną ze względu na jej prostotę zawarto w tabeli 1.7
Poza obecnością sekwencji wielowodzie/małowodzie brak widocznego pęcherza moczowego u dawcy warunkuje zakwalifikowanie pacjentki do II stopnia zaawansowania. Niezależnie od obecności pęcherza moczowego dawcy pojawienie się zaburzeń przepływu w badaniu doplerowskim w wymienionych w tabeli naczyniach oznacza kwalifikację do III stopnia, przy czym u pacjentek z obecnym pęcherzem moczowym określa się to jako nietypowy III stopień. Obecność obrzęku uogólnionego kwalifikuje pacjentkę do IV stopnia, a obumarcie przynajmniej jednego płodu – do V stopnia zaawansowania.
Leczenie
Niezależnie od stopnia zaawansowania możliwości terapeutyczne zależą w dużym stopniu od wieku ciąży. Pojawienie się TTTS przed ukończeniem 16 tygodnia oznacza w zasadzie brak jakichkolwiek możliwości leczenia. Podejmowane są próby przeprowadzenia zabiegów fetoskopowych w tak wczesnej ciąży, ale wyniki tych prób są kontrowersyjne.8
Od ukończenia 16 do ukończenia 26 tygodnia ciąży optymalne jest leczenie przyczynowe, czyli fotokoagulacja naczyń łączących lub zamknięcie pępowiny jednego z płodów, ewentualnie wspomagane farmakoterapią (glikozydy naparstnicy, steroidy, tokoliza). Po ukończeniu 26 tygodni ciąży uważa się, że czas do osiągnięcia przez płody dużych szans na przeżycie i prawidłowy rozwój po urodzeniu jest już na tyle krótki, a ryzyko związane z fetoskopią na tyle duże, że proponuje się leczenie objawowe. Stosuje się wówczas amnioredukcje seryjne, które zmniejszają skłonność do czynności skurczowej i porodu przedwczesnego, albo indometacynę lub sulindak, zmniejszające w sposób nieinwazyjny objętość płynu owodniowego u biorcy. Daje to czas na stymulację dojrzewania płuc płodów steroidami i przygotowanie pacjentki do porodu. Jeśli obserwowane są cechy niewydolności krążenia u biorcy, można również podać pacjentce glikozydy naparstnicy.1,5,9
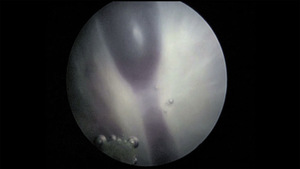
Przed wprowadzeniem do leczenia fetoskopowej laserowej koagulacji naczyń łączących (ryc. 2), również w II trymestrze ciąży wykonywano seryjne amnioredukcje. Pozwalało to istotnie przedłużyć czas trwania ciąży, ale ze względu na objawowy charakter tej metody nie hamowało postępu zmian hemodynamicznych u płodów. Prowadziło to stosunkowo często do trwałych uszkodzeń ośrodkowego układu nerwowego (OUN) i nieprawidłowego rozwoju psychoruchowego dzieci. Laseroterapia została porównana do seryjnych amnioredukcji w wielu pracach, ale niewiele z nich sięga obserwacją poza 28 dzień życia dzieci.10-12