IVM jest metodą eksperymentalną. W 2020 roku odnotowano pierwsze żywe urodzenie po jej zastosowaniu, a następnie witryfikacji tak przygotowanych oocytów u pacjentki onkologicznej. 29-letnia nieródka z rozpoznaniem raka piersi w stopniu III zaawansowania przed rozpoczęciem leczenia nowotworu została poddana aspiracji przezpochwowej oocytów pod kontrolą ultrasonografii (USG) w 22 dniu cyklu miesiączkowego. W ten sposób pobrano 7 niedojrzałych oocytów, które poddano procedurze IVM (przez 48 godzin), dzięki czemu uzyskano 6 komórek jajowych w stadium metafazy II mejozy. Tak przygotowane oocyty zamrożono metodą witryfikacji. Po 5 latach od rozpoznania choroby u pacjentki stwierdzono niepłodność i zdecydowano o wykorzystaniu zamrożonych komórek jajowych. Po rozmrożeniu wszystkie 6 komórek jajowych zostało zapłodnionych metodą ICSI, a jeden z zarodków podano pacjentce. Ciąża przebiegała bez powikłań, a poród odbył się o czasie13.
IVM jest metodą o dużym potencjale rozwojowym. W przyszłości może stanowić ważną opcję dla pacjentek, które nie mogą odwlekać rozpoczęcia leczenia onkologicznego, a także dla dziewczynek przed pokwitaniem.
Supresja hormonalna jajników w trakcie chemioterapii za pomocą analogów GnRH
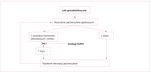
Rycina 1. Mechanizm uszkodzenia pęcherzyków jajnikowych (burn-out) w przebiegu chemioterapii oraz działanie analogów GnRH na ten mechanizm
Zastosowanie analogów GnRH w trakcie chemioterapii jest metodą budzącą obecnie najwięcej kontrowersji, mimo (a może właśnie dlatego) że jest to jak dotąd jedyna opcja w oncofertility będąca przedmiotem badań z randomizacją. W odniesieniu do ochronnego wpływu syntetycznych analogów GnRH (takich jak: goserelina, tryptorelina, leuprorelina, buserelina) na jajniki postuluje się obecnie 5 potencjalnych mechanizmów działania14:
- osiągnięcie stanu hipogonadyzmu takiego jak przed pokwitaniem lub po menopauzie – zwraca się uwagę, że jajniki dziewczynek przed pokwitaniem są znacznie odporniejsze na działanie gonadotoksycznych chemioterapeutyków niż u kobiet dorosłych. Nie wiadomo jednak, czy jest to związane ze statusem hormonalnym, czy z większą rezerwą jajnikową. U kobiet poddawanych chemioterapii obserwuje się mechanizm uszkodzenia pęcherzyków jajnikowych określany w piśmiennictwie jako burn-out (wypalenie). Zastosowanie analogów GnRH dzięki zahamowaniu wydzielania folikulotropiny (FSH – follicle-stimulating hormone) w przysadce mózgowej przerywa jedną z dróg nadmiernej rekrutacji i destrukcji pęcherzyków jajnikowych w tym mechanizmie (ryc. 1)
- bezpośrednie działanie na jajniki – w warunk ach in vitro wykazano, że buserelina hamuje toksyczny efekt doksorubicyny niezależnie od stężenia gonadotropin. Dokładny mechanizm nie jest jeszcze znany, prawdopodobnie jest to jednak związane z obecnością na powierzchni komórek jajnikowych receptorów dla GnRH
- zmniejszenie perfuzji jajnikowej spowodowane hipoestrogenizmem i tym samym mniejsze narażenie tkanki jajnikowej na bezpośrednie toksyczne działanie chemioterapeutyków
- nasilenie produkcji substancji działających ochronnie na jajniki, takich jak sfingozyno-1-fosfataza (S1P – sphingosine-1-phosphate) – w badaniach na modelu zwierzęcym wykazano ochronne działanie S1P na komórki jajnikowe, nie udowodniono jednak, że analogi GnRH rzeczywiście wpływają na produkcję S1P
- wpływ ochronny na komórki macierzyste jajników (GSC – germinative stem cells) – jest to tylko spekulacja, niepoparta jak dotąd dowodami naukowymi, niemniej podnoszona przez najważniejszych badaczy zajmujących się tym problemem.
Podejście klinicystów do zastosowania analogów GnRH w celu zabezpieczenia płodności było różne – od początkowo pozytywnego przez negatywne i ponownie zmieniło się na pozytywne. Wyniki randomizowanych badań, jak również metaanaliz dotyczących skuteczności analogów GnRH w zabezpieczeniu płodności są sprzeczne. Pojawia się coraz więcej dowodów na korzyści płynące z takiego postępowania, lecz warto podkreślić, że w wielu z dostępnych badań oceniano takie parametry jak powrót cykli miesiączkowych czy występowanie owulacji, co nie do końca przekłada się na wyniki dotyczące płodności, a więc przede wszystkim odsetki ciąż i żywych urodzeń. Powrót krwawień miesiączkowych nie jest bowiem jednoznaczny z możliwością zajścia w ciążę i urodzenia żywego, zdrowego dziecka. Jedynym badaniem, w którym oceniano liczbę ciąż jako pierwotnie planowany punkt końcowy, było Prevention of Early Menopause Study (POEMS)15. Autorzy tej pracy wykazali znamiennie większy odsetek ciąż u pacjentek z rakiem piersi receptorowo negatywnym otrzymujących goserelinę razem z chemioterapią w porównaniu z kobietami poddanymi samej chemioterapii (21% vs 11%, p = 0,03). Wyniki pozostałych najważniejszych badań z randomizacją dotyczących stosowania analogów GnRH w trakcie chemioterapii w celu ochrony funkcji jajników podsumowano w tabeli 214-17.

Tabela 2. Najważniejsze badania randomizowane dotyczące zastosowania analogów GnRH w trakcie chemioterapii w celu zabezpieczenia płodności u pacjentek onkologicznych15-17
W dostępnych metaanalizach również nie potwierdzono jednoznacznie korzyści wynikających z zastosowania analogów GnRH w zapobieganiu utracie płodności u kobiet chorych na nowotwory. Jednym z najistotniejszych czynników wpływających na te wyniki są różne definicje przedwczesnego wygasania czynności jajników, które jest najczęstszym głównym punktem końcowym przeprowadzonych badań. W 2019 roku opublikowano wyniki przeglądu systematycznego bazy Cochrane, do którego włączono 12 badań randomizowanych, w tym 1369 kobiet w wieku 12-51 lat. Pacjentki chorowały na raka piersi, chłoniaka Hodgkina oraz nowotwory jajnika, a większość z nich była leczona lekami alkilującymi lub terapią opartą na pochodnych platyny. Powrót miesiączek w ciągu 12 miesięcy zaobserwowano u 178 z 239 (74,5%) kobiet przyjmujących analogi GnRH razem z chemioterapią w porównaniu z 110 pacjentkami spośród 221 (50,0%) leczonych wyłącznie chemioterapią (ryzyko względne [RR – relative risk] 1,60; 95% przedział ufności [CI – confidence interval] 1,14-2,24; p = 0,006). POF stwierdzono u 43 z 401 (10,7%) chorych z grupy otrzymującej analogi GnRH oraz u 96 z 379 (25,3%) kobiet z grupy leczonej wyłącznie chemioterapią (RR 0,44; 95% CI 0,31-0,61; p <0,00001). Ciążę potwierdzono u 32 z 356 (9,0%) pacjentek z grupy stosującej analogi GnRH w porównaniu z 22 kobietami spośród 347 (6,3%) poddanych samej chemioterapii (RR 1,59; 95% CI 0,93-2,7; p = 0,09). Autorzy przeglądu podkreślają jednak, że brak istotności statystycznej w tym przypadku należy traktować ostrożnie, ponieważ brakuje informacji o tym, czy pacjentki biorące udział w badaniach próbowały/chciały wówczas zajść w ciążę18.
Obecnie najbardziej opiniotwórcze światowe towarzystwa, takie jak: ASRM, ASCO czy NCCN (National Comprehensive Cancer Network), zalecają rozważenie podania analogów GnRH w trakcie chemioterapii kobietom, u których nie ma możliwości zastosowania innych metod zabezpieczenia płodności. Zwraca się również uwagę na potencjalne dodatkowe korzyści wynikające z przyjmowania tych leków, takie jak np. istotne zmniejszenie ryzyka krwawień z dróg rodnych u kobiet i dziewcząt z trombocytopenią lub leukopenią. Działania niepożądane tych środków obejmują: uderzenia gorąca, zaburzenia nastroju, suchość pochwy. Dolegliwości te są podobne do symptomów, które mogą występować w trakcie terapii gonadotoksycznej. We wspomnianym wcześniej przeglądzie bazy Cochrane nie odnotowano istotnych różnic w nasileniu tych objawów między grupą, u której zastosowano chemioterapię + analogi GnRH, a grupą poddaną samej chemioterapii6,9,14,18,19.
Podsumowanie zalet i wad wszystkich opisanych wyżej metod zabezpieczenia płodności u kobiet przedstawiono w tabeli 3.

Tabela 3. Zalety i wady metod zabezpieczenia płodności u kobiet leczonych z powodu nowotworów złośliwych
Zabezpieczenie płodności u mężczyzn
U mężczyzn komórki spermatogenezy są znacznie wrażliwsze na chemioterapię i radioterapię niż komórki Leydiga, dlatego leczenie onkologiczne upośledza przede wszystkim płodność, a stężenie testosteronu pozostaje zwykle w granicach normy i najczęściej nie dochodzi do zaburzeń seksualnych ani zaburzeń w dojrzewaniu płciowym.
Główną metodą zachowania płodności u mężczyzn jest zamrażanie nasienia. Procedura ta jest prosta, łatwo dostępna, skuteczna i nie wymaga odroczenia leczenia onkologicznego. Nasienie można uzyskać w wyniku masturbacji, wówczas zaleca się zabezpieczenie przynajmniej 2-3 próbek, aby zapewnić wystarczającą liczbę plemników do zamrożenia. Podkreśla się także konieczność zabezpieczenia próbek nasienia do krioprezerwacji przed rozpoczęciem terapii gonadotoksycznej ze względu na ryzyko istotnego uszkodzenia DNA plemników, do którego może dojść już w pierwszym kursie leczenia. Jeżeli z jakichś powodów (np. młody wiek, uszkodzenia neurologiczne, choroby współistniejące, w tym depresja) oddanie nasienia poprzez masturbację nie jest możliwe, próbkę spermy można uzyskać dzięki zastosowaniu inhibitorów fosfodiesterazy, stymulacji wibracyjnej, elektrostymulacji transrektalnej przeprowadzanej w znieczuleniu, z ejakulacji wstecznej, a także na drodze chirurgicznej (biopsja jąder lub najądrzy). Skuteczna krioprezerwacja spermy jest możliwa u 85-100% pacjentów w zależności od rozpoznania i wieku pacjenta, a zamrożone nasienie może być przechowywane bardzo długo bez istotnej utraty właściwości (w opisanych przypadkach najdłuższy czas wynosił 28 lat). W największym jak do tej pory badaniu dotyczącym skuteczności tej metody u pacjentów onkologicznych odsetek żywych urodzeń na cykl po wykorzystaniu mrożonego nasienia wynosił: 14,3% dla inseminacji domacicznej (IUI – intrauterine insemination), 25% dla zapłodnienia pozaustrojowego (IVF – in vitro fertilisation) i 28,3% dla ICSI4,6,9.
Ogromny problem stanowi natomiast możliwość zabezpieczenia płodności u chłopców w wieku przedpokwitaniowym, od których nie można pozyskać dojrzałych plemników, aby je zamrozić, zwłaszcza że odwrotnie niż u dziewczynek jądra przed okresem dojrzewania są bardziej podatne na uszkodzenie spowodowane leczeniem onkologicznym niż u dorosłych mężczyzn. Obecnie trwają badania nad opracowaniem metod, które mogłyby rozwiązać ten problem.
Pierwszą możliwą strategią jest leczenie farmakologiczne. Zastosowanie analogów GnRH u chłopców i mężczyzn poddawanych chemioterapii okazało się nieskuteczne. W badaniach na modelach zwierzęcych wykazano wprawdzie ochronny wpływ na proces spermatogenezy takich substancji, jak czynnik wzrostu kolonii granulocytów (G-CSF – granulocyte-colony stimulating factor) czy melatonina, jednak jak dotąd nie przeprowadzono podobnych badań z udziałem ludzi6,20.
Procedurą rozważaną u chłopców przed okresem pokwitania, nad którą trwają obecnie intensywne badania, jest zamrażanie tkanki jądra. Szesnaście ośrodków na świecie, w tym 7 w Europie, oferuje pacjentom pobranie i krioprezerwację tkanki jądra jako metodę eksperymentalną. Pierwszy taki zabieg wykonano w 2002 roku, obecnie zabezpieczono tkanki około 700 pacjentów. Strategie uzyskania dojrzałych komórek rozrodczych z pobranej niedojrzałej tkanki jądra obejmują procedury przeprowadzane in vitro (różnego rodzaju hodowle i kultury) oraz in vivo – autotransplantację tkanki lub wyizolowanych z niej komórek macierzystych spermatogenezy (SSC – spermatogonial stem cells). Metody te pozwoliły na powstanie gamet zdolnych do zapłodnienia u wielu gatunków ssaków. Mimo to u człowieka dotąd nie udało się uzyskać z zamrożonej tkanki dojrzałych plemników umożliwiających zapłodnienie. Przeprowadzono już co najmniej kilka autotransplantacji rozmrożonej tkanki jądra, jednak nie ma informacji o wynikach tych procedur. Potrzebne są intensywne badania nad możliwością rozwoju tej metody.