Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Tajniki ultrasonografii
Nieimmunologiczny obrzęk płodu
Wyzwania diagnostyczne ze szczególnym uwzględnieniem zaawansowanej diagnostyki genetycznej
dr hab. n. med. Julia Bijok
- Definicja, epidemiologia i etiologia nieimmunologicznego obrzęku płodu
- Przegląd klasycznych metod diagnostycznych
- W poszukiwaniu genetycznych przyczyn obrzęku – zastosowanie nowoczesnych metod diagnostyki molekularnej
Obrzęk płodu (łac. hydrops fetalis) definiowany jest jako gromadzenie się płynu w co najmniej dwóch jamach ciała, takich jak: jama otrzewnej, jama opłucnej, jama osierdzia, lub w jednej jamie ciała i tkance podskórnej. Nadmierna akumulacja płynu może być następstwem zwiększonego ciśnienia żylnego (np. w przypadku wad serca powodujących niewydolność krążenia), zmniejszonego ciśnienia onkotycznego osocza (np. w związku z niedostateczną produkcją białek osocza w przypadku zapalenia wątroby u płodu z infekcją), jak również niedostatecznego odpływu chłonki (np. u płodów z torbielami limfatycznymi w przebiegu aberracji chromosomowych). Obrzęk może zarówno towarzyszyć mnogim wadom płodu, jak i występować u płodów o całkowicie prawidłowej budowie anatomicznej. Złożona etiologia obrzęku płodu obejmuje czynniki genetyczne, infekcyjne, kardiologiczne, metaboliczne i hematologiczne1.
Klasycznie obrzęk płodu ze względu na jego etiologię klasyfikowany jest jako obrzęk immunologiczny (IHF – immune hydrops fetalis), czyli związany z występowaniem u matki przeciwciał przeciwko krwinkom czerwonym płodu, lub jako obrzęk nieimmunologiczny (NIHF – non-immune hydrops fetalis), który obecnie występuje zdecydowanie częściej (w krajach rozwiniętych stanowi 85-90% przypadków obrzęku płodu) i na tym zagadnieniu koncentruje się niniejsze opracowanie. Brak ustalenia przyczyny NIHF może wpływać negatywnie na podejmowanie przyszłych decyzji prokreacyjnych. Dlatego tak ważne jest propagowanie wiedzy dotyczącej tej patologii, jak również objęcie pacjentek opieką specjalistyczną przez ośrodki dysponujące rozbudowanym zapleczem diagnostyczno-terapeutycznym.
Nieimmunologiczny obrzęk płodu występuje z częstością 1 : 1500-1 : 4000 urodzeń. W niektórych przypadkach, szczególnie jeśli w badaniach prenatalnych nie stwierdzono innych nieprawidłowości, obrzęk może ustąpić samoistnie i istnieje szansa na prawidłowy rozwój dziecka, jednak w większości przypadków NIHF wiąże się z wysoką, dochodzącą do 90%, śmiertelnością perinatalną1,2. Rzadkim, lecz bardzo niebezpiecznym, powikłaniem NIHF jest tzw. zespół lustrzany u matki (mirror syndrome, inaczej zespół Ballantyne’a), w którym u ciężarnej rozwijają się objawy przypominające te obserwowane u płodu3,4. Zespół lustrzany charakteryzuje się triadą objawów: obrzękiem płodu, obrzękiem łożyska oraz obrzękami u matki. Patogeneza tego zespołu nie jest w pełni poznana. Objawy kliniczne u matki mogą obejmować nadciśnienie tętnicze, białkomocz oraz uogólnione obrzęki, co może przypominać stan przedrzucawkowy. Objawem różnicującym jest obniżenie hematokrytu typowe dla zespołu lustrzanego w odróżnieniu od zagęszczenia krwi obserwowanego w stanie przedrzucawkowym. Wystąpienie zespołu lustrzanego stanowi poważne zagrożenie zarówno dla matki, jak i dla płodu, zwiększa śmiertelność płodów oraz zachorowalność matek4.
Medycyna prenatalna dysponuje obecnie szeroką gamą zaawansowanych interwencji wewnątrzmacicznych, które w wybranych przypadkach ciężkiego NIHF mogą poprawić rokowanie płodu oraz złagodzić objawy zespołu lustrzanego u ciężarnej lub im zapobiec5. Do kluczowych procedur należą transfuzje dopłodowe stosowane w przypadkach ciężkiej niedokrwistości płodu oraz shunty zakładane do jamy opłucnej w przypadku znacznego nagromadzenia płynu (hydrothorax). W niewielkiej części przypadków (np. NIHF w wyniku niedokrwistości o przejściowej przyczynie infekcyjnej, np. coraz częściej odnotowywane zakażenie parwowirusem B19) zastosowana metoda może prowadzić do pełnego wyleczenia płodu. Terapią o niekwestionowanej skuteczności, udowodnionej w licznych badaniach randomizowanych, jest również laserowa koagulacja połączeń naczyniowych w przypadku zespołu przetoczenia między płodami w ciąży bliźniaczej jednokosmówkowej. Należy jednak zaznaczyć, że możliwość zastosowania efektywnej terapii wewnątrzmacicznej dotyczy jedynie niewielkiego odsetka płodów z NIHF5.
Wybór odpowiedniej metody terapeutycznej zależy od precyzyjnego ustalenia etiologii NIHF oraz oceny stanu płodu i matki. Przed podjęciem decyzji o interwencji konieczne jest wnikliwe rozważenie zasadności takiego leczenia, w tym wykluczenie letalnych przyczyn NIHF, takich jak ciężkie wady genetyczne. Mimo postępów w diagnostyce prenatalnej i postnatalnej etiologia NIHF pozostaje niewyjaśniona w mniej więcej 20% przypadków1. Rozwój zaawansowanych technologii genetyki molekularnej, w tym sekwencjonowania eksomowego (ES – exome sequencing), a nawet sekwencjonowania całego genomu (GS – genome sequencing), może stanowić klucz do lepszego zrozumienia mechanizmów odpowiedzialnych za NIHF, co w przyszłości może wpłynąć na bardziej precyzyjne planowanie terapii.
Klasyczne metody diagnostyczne
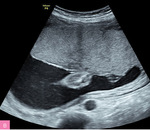
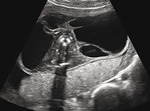
Rycina 1. 22 tydzień ciąży; C I, P I. Wodobrzusze u płodu spowodowane ciężką niedokrwistością w przebiegu konfliktu serologicznego w układzie Kell (Hb 1,7 mg/dl, Ht 5,5%, E 0,4 mln/μl). Pacjentka zakwalifikowana do leczenia wewnątrzmacicznego transfuzjami dopłodowymi – obrzęk ustąpił po trzeciej transfuzji
W diagnostyce różnicowej obrzęku konieczne jest w pierwszej kolejności wykluczenie konfliktu serologicznego, co w praktyce sprowadza się do sprawdzenia obecności w surowicy matki przeciwciał przeciwko krwinkom czerwonym płodu6,7. Należy podkreślić, że obrzęk immunologiczny może również występować u pacjentek z dodatnią grupą krwi w układzie RhD, gdyż może dotyczyć innych układów, np. Kell, Duffy, MNS8 (ryc. 1). Brak obecności przeciwciał przeciw krwinkom czerwonym w surowicy ciężarnej wyklucza immunologiczną przyczynę obrzęku płodu, jednak ich występowanie nie musi przesądzać o etiologii. Przeciwciała mogą bowiem mieć niewielkie powinowactwo do krwinek czerwonych bądź występować w mianie zbyt niskim, aby wywołać istotną niedokrwistość.
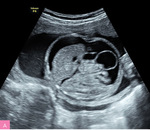
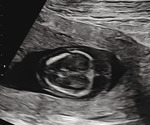
Rycina 2A, B. 23 tydzień ciąży; C II, P II. Wodobrzusze u płodu z niedokrwistością w przebiegu infekcji parwowirusem B19 (Hb 8 mg/dl, PLT 123 000 G/l). U starszego dziecka stwierdzono rumień zakaźny 6 tygodni wcześniej. Uwagę zwraca grube łożysko. Pacjentka zakwalifikowana do leczenia wewnątrzmacicznego transfuzjami dopłodowymi – obrzęk ustąpił po drugiej transfuzji
Niedokrwistość płodu, która jest jedną z podstawowych przyczyn obrzęku, może być spowodowana wieloma innymi czynnikami, takimi jak np. infekcja, przetoczenie płodowo-matczyne czy hemoglobinopatie i inne wrodzone choroby hematologiczne1,9,10 (ryc. 2). Przyczynami niedokrwistości u płodu mogą też być zespół przetoczenia krwi między płodami (TTTS – twin-to-twin transfusion syndrome), występujący w mniej więcej 15% ciąż bliźniaczych jednokosmówkowych, oraz zespół anemia–policytemia (TAPS – twin anemia-polycythemia sequence). Powikłania ciąż bliźniaczych, podobnie jak diagnostyka infekcji, które mogą prowadzić do obrzęku płodu (np. zakażenie parwowirusem B19, wirusem cytomegalii [CMV – cytomegalovirus], toksoplazmoza, kiła), wymagają jednak oddzielnego omówienia.
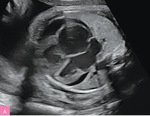
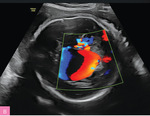
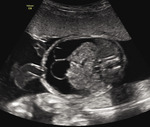
Rycina 3A, B. 30 tydzień ciąży; C I, P I. Pacjentka skierowana z powodu kardiomegalii i nieprawidłowego obrazu ośrodkowego układu nerwowego. W badaniu stwierdzono malformację tętniczo-żylną Galena (tętniak żyły Galena) i wtórną niewydolność krążenia (powiększona sylwetka serca, znacznego stopnia niedomykalność zastawki trójdzielnej i mitralnej, wsteczny przepływ w przewodzie żylnym). Pacjentkę poinformowano o poważnym rokowaniu (prawdopodobny zgon po urodzeniu). Poród odbył się w 37 tygodniu ciąży. Zgon noworodka nastąpił w pierwszej godzinie życia
Podstawę diagnostyki NIHF stanowi szczegółowe badanie ultrasonograficzne, które pozwala na ocenę anatomii płodu oraz wykrycie ewentualnych towarzyszących wad strukturalnych. Istnieje wiele nieprawidłowości będących bezpośrednią przyczyną zwiększonej akumulacji płynu w jamach ciała i są to zazwyczaj stany prowadzące do niewydolności krążenia, takie jak zaburzenia rytmu serca (w szczególności tachyarytmie), niektóre wady serca (np. ciężka stenoza aortalna lub krytyczne zwężenie zastawki płucnej u płodu), a także wady związane z krążeniem hiperkinetycznym, w tym bogato unaczynione guzy płodu lub łożyska (np. lity potworniak kości krzyżowej). Malformacja żyły Galena (tętniak żyły Galena) to niezwykle rzadka patologia płodu charakteryzująca się występowaniem nieprawidłowego połączenia pomiędzy tętnicami a żyłą Galena – krótkim naczyniem utworzonym w miejscu spływu żył mózgu wewnętrznych i żył podstawnych Rosenthala, odprowadzającym krew żylną do zatoki prostej. Malformacja wiąże się ze znacznym zwiększeniem przepływu krwi w mózgu płodu, co może skutkować poważnymi konsekwencjami klinicznymi, takimi jak niewydolność krążenia i obrzęk. Ze względu na zmiany hemodynamiczne po porodzie wykryta prenatalnie malformacja Galena niemal bez wyjątku wiąże się ze złym rokowaniem i zgonem noworodka w pierwszych godzinach życia (ryc. 3). Kolejną grupę stanowią anomalie powodujące ucisk w klatce piersiowej, np. wrodzona gruczolakowatość torbielowata płuc (CCAM – congenital cystic adenomatoid malformation), sekwestracja płucna lub potworniaki i inne guzy śródpiersia1. Należy mieć jednak na uwadze, że występowanie nieprawidłowości strukturalnych nie wyklucza genetycznej etiologii NIHF. Podobnie infekcja płodu może się nałożyć na inne podłoże, np. wrodzoną dziedziczną niedokrwistość. Nietypowy przebieg kliniczny zawsze wymaga wnikliwej analizy.