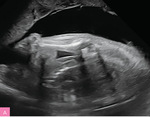
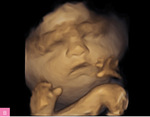
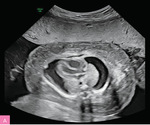
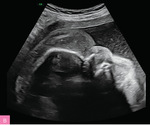
Najczęstszą aberracją chromosomową w NIHF jest monosomia X (ryc. 4), ale obrzęk może występować również u płodów z innymi aberracjami, np. trisomią 21, 18 i 13 (ryc. 5), a także triploidią11-13. Standardowe badanie genetyczne stosowane w diagnostyce prenatalnej, czyli porównawcza hybrydyzacja genomowa do mikromacierzy (aCGH – array comparative genomic hybridization), pozwala na identyfikację aberracji chromosomowych, takich jak trisomie i monosomia X, delecje czy duplikacje, nie wykrywa jednak triploidii, której wykluczenie wymaga wykorzystania innych metod genetycznych.
Aberracje chromosomowe możliwe do wykrycia za pomocą aCGH są najczęstszą przyczyną obrzęku płodu w I trymestrze ciąży1,12. W przypadku obrzęku rozwijającego się na późniejszym etapie ciąży diagnostyka może wymagać bardziej zaawansowanych narzędzi, takich jak sekwencjonowanie eksomowe (ES), a nawet sekwencjonowanie genomowe (GS), które zostaną omówione w dalszej części opracowania. NIHF może bowiem występować w różnych zespołach związanych z patogennymi wariantami w specyficznych genach, których wykrycie nie jest możliwe przy użyciu klasycznego badania cytogenetycznego lub aCGH (w tzw. chorobach monogenowych)14.
Znanych jest ponad 80 jednostek chorobowych dziedziczonych monogenowo, które mogą się wiązać z występowaniem NIHF, a do najczęściej opisywanych w literaturze należą tzw. RASopatie11,12. Są to rzadkie, dziedziczne schorzenia spowodowane patogennymi wariantami w genach kodujących białka szlaku sygnalizacyjnego RAS/MAPK prowadzącymi do jego nadmiernej aktywacji. Szlak RAS/MAPK odgrywa kluczową rolę w regulacji proliferacji, różnicowania, dojrzewania i apoptozy komórek, a jego zaburzenia skutkują nieprawidłowym rozwojem tkanek i narządów, a także zwiększonym ryzykiem nowotworów. Jednym z najczęściej występujących zaburzeń w tej grupie jest zespół Noonan, którego cechami charakterystycznymi są: niski wzrost, dysmorfia twarzy, wady serca i opóźnienie rozwoju. W okresie prenatalnym u płodów z tym zespołem często obserwuje się zwiększoną przezierność karkową (NT – nuchal translucency) w I trymestrze ciąży, a w II trymestrze – wodniaka karku, obrzęk tkanki podskórnej oraz obecność hydrothorax. Diagnostyka genetyczna w kierunku zespołu Noonan obejmuje analizę takich genów, jak: PTPN11, SOS1, KRAS, RAF1, BRAF, MEK1/2 oraz NF1, choć patogenne warianty mogą występować również w innych genach11,15.
Dysplazje kostne obejmują ponad 400 różnych jednostek chorobowych. Patogenne warianty genetyczne prowadzą do objawowych zaburzeń formowania układu szkieletowego, a zmienna penetracja i ekspresja poszczególnych wariantów odpowiada za zróżnicowane nasilenie objawów. Niektóre choroby kości diagnozowane są dopiero po urodzeniu, jednak część dysplazji, w tym dysplazja tanatoforyczna, dysplazja kampomeliczna czy osteogenesis imperfecta, charakteryzuje się ciężkim lub letalnym przebiegiem. Zespoły te są często związane z defektami strukturalnymi i hemodynamicznymi, które mogą przyczyniać się do obrzęku, szczególnie w połączeniu z wadami serca lub układu limfatycznego16. Mutacje w genach, takich jak FLT4, który jest związany z wrodzonymi wadami układu chłonnego, mogą prowadzić do uogólnionego obrzęku płodu wynikającego z niewydolności drenażu limfatycznego. Ponadto mutacje w genach odpowiedzialnych za rozwój układu sercowo-naczyniowego, takich jak NKX2-5 czy MYH7, mogą prowadzić do wad wrodzonych serca i wtórnego obrzęku płodu.
Choroby metaboliczne stanowią grupę rzadkich zaburzeń, w których patogenne warianty genetyczne prowadzą na poziomie komórkowym do dysfunkcji enzymatycznych lub zaburzeń w procesach metabolicznych. Do najczęściej opisywanych w piśmiennictwie należą: wrodzone defekty metabolizmu glikogenu, wrodzone zaburzenia glikozylacji białek (CDG – congenital disorders of glycosylation) oraz zaburzenia w metabolizmie lipidów i lizosomalne choroby spichrzeniowe, takie jak choroba Niemanna-Picka typu C czy choroba Gauchera. W tych przypadkach obrzęk płodu jest często skutkiem uogólnionej dysfunkcji narządowej prowadzącej do upośledzenia funkcji wątroby, serca lub układu limfatycznego17. Przed wprowadzeniem zaawansowanych metod genetyki molekularnej diagnostyka chorób metabolicznych opierała się na badaniu aktywności wybranych enzymów w płynie owodniowym. Ze względu na celowany charakter badania i konieczność pozyskania znacznej objętości płynu owodniowego metoda ta miała jednak ograniczone znaczenie w okresie prenatalnym. Obecnie prowadzone są badania nad zastosowaniem terapii enzymatycznej w leczeniu chorób lizosomalnych już w okresie prenatalnym. Dr Tippi MacKenzie i jej zespół z University of California w San Francisco prowadzą przełomowe badania w zakresie chorób metabolicznych, takich jak lizosomalne choroby spichrzeniowe. Badacze w szczególności koncentrują się na wewnątrzmacicznym podawaniu enzymów zastępczych (IUERT – in utero enzyme replacement therapy), co ma na celu zapobiegnięcie uszkodzeniom ośrodkowego układu nerwowego na etapie niedojrzałej bariery krew–mózg. Wyniki wstępnych badań klinicznych (NCT04532047) wskazują, że IUERT może być skutecznym narzędziem w prewencji nieodwracalnych uszkodzeń narządów i rozwoju odpowiedzi immunologicznej na białka terapeutyczne18.
Ustalenie genetycznego podłoża NIHF ma kluczowe znaczenie dla poradnictwa genetycznego, pozwala na lepsze oszacowanie ryzyka nawrotu oraz planowanie postępowania w przyszłych ciążach11,14,19. Choroby monogenowe dziedziczone autosomalnie recesywnie wiążą się z wysokim ryzykiem powtórzenia w kolejnej ciąży, które wynosi 25%. Ustalenie nosicielstwa chorób dziedziczonych autosomalnie recesywnie umożliwia diagnostykę preimplantacyjną w przypadku zastosowania metod wspomaganego rozrodu bądź celowaną diagnostykę prenatalną z materiału pozyskanego na drodze biopsji kosmówki, co zwiększa szanse na urodzenie zdrowego dziecka. Ze względu na możliwość mozaikowatości ograniczonej do gonad NIHF może pojawić się w kolejnej ciąży również w przypadku chorób dziedziczonych autosomalnie dominująco. Zidentyfikowanie podłoża genetycznego NIHF ma kluczowe znaczenie dla zrozumienia patomechanizmu obrzęku i może otworzyć drogę do specyficznych terapii enzymatycznych w okresie pre- i postnatalnym.
Nowoczesne metody diagnostyki molekularnej
Sekwencjonowanie eksomowe to zaawansowana technika genetyczna umożliwiająca analizę wszystkich sekwencji kodujących białka w celu identyfikacji wariantów o potencjalnym charakterze patogennym20. Metoda ta znajduje szczególne zastosowanie w diagnostyce chorób monogenowych, które nie są możliwe do wykrycia z pomocą klasycznych metod cytogenetycznych, takich jak prążkowa analiza kariotypu czy kariotyp molekularny z użyciem mikromacierzy (aCGH).
Od kilku lat ES zyskuje coraz większe znaczenie w diagnostyce prenatalnej NIHF. Częstość wykrywania patogennych wariantów genetycznych w różnych populacjach jest zróżnicowana i zależy od obecności towarzyszących wad strukturalnych21-26. Przykładowo w badaniu Lord i wsp. odsetek zidentyfikowanych patogennych wariantów wynosił 9%23, podczas gdy w badaniu HYDROPS osiągnął nawet 50%24. W badaniu przeprowadzonym przez Deng i wsp. w grupie 109 płodów z NIHF w podgrupie 21 przypadków z prawidłowym wynikiem aCGH zidentyfikowano 3 patogenne warianty (14,3%) oraz 2 warianty o nieznanej patogenności (VUS – variants of uncertain significance), co stanowiło dodatkową wartość diagnostyczną2. Z kolei Sparks i wsp. w swoim prospektywnym badaniu wykazali, że zastosowanie ES pozwala na postawienie diagnozy genetycznej w 29% przypadków25.
Na podstawie metaanalizy Mone i wsp. potwierdzili, że ES przynosi dodatkową wartość diagnostyczną w 39% przypadków płodów z NIHF i towarzyszącymi wadami strukturalnymi26. Te dane jednoznacznie podkreślają znaczenie ES jako niezastąpionego narzędzia w kompleksowej ocenie etiologii NIHF. W innym badaniu, przeprowadzonym przez Liu i wsp., przeanalizowano 53 przypadki niewyjaśnionego NIHF, w tym 39 płodów spełniało ścisłą definicję NIHF, a 14 charakteryzowało się jedynie podwyższoną NT i/lub obecnością wodniaka karku. Patogenne warianty genetyczne zidentyfikowano w 23% przypadków (12 z 53), a potencjalnie patogenne w dodatkowych 13% (7 z 53). Co istotne, w 3 przypadkach (7%) diagnozę postawiono dopiero po ponownej analizie danych. Najwyższy odsetek wykrytych wariantów patogennych i potencjalnie patogennych (43%) odnotowano w grupie płodów z obrzękiem skóry oraz z podwyższoną NT lub wodniakiem karku. W tej grupie liczącej 14 płodów rozpoznanie ustalono w 6 przypadkach. Natomiast w klasycznych przypadkach NIHF częstość wykrycia patogennych wariantów wynosiła 15% (6 z 39). W badaniu tym wskazano również na wpływ zastosowania ES na podejmowane decyzje kliniczne, gdyż odsetek terminacji ciąży w grupie z wykrytymi patogennymi wariantami genetycznymi był znacząco wyższy niż w grupie z prawidłowym wynikiem ES (92% vs 54%), a odsetek żywych urodzeń w tych grupach wynosił odpowiednio 8% i 37%27.
Rycina 6A, B. 33 tydzień ciąży; C I, P I. Obrzęk płodu od 20 tygodnia ciąży. Wielowodzie. Uwagę zwracało wyprostne ustawienie kończyn przez cały czas badania USG. Wynik badania aCGH prawidłowy. Ze względu na podejrzenie choroby skórno-mięśniowej o podłożu monogenowym wykonano ES – stwierdzono patogenny wariant w genie ACTA1 powodujący letalną miopatię nemalinową. Poród przedwczesny w 33 tygodniu ciąży, okołoporodowy zgon płodu
W ramach badań własnych prowadzonych we współpracy z Zakładem Genetyki Medycznej Instytutu Matki i Dziecka w Warszawie przeanalizowano grupę 10 płodów z rozpoznanym NIHF oraz prawidłowym wynikiem aCGH. Średni wiek ciąży w momencie wykrycia obrzęku wynosił 18 tygodni. U 8 z 10 płodów (80%) zaobserwowano dodatkowe wady strukturalne, co wskazuje na częste współwystępowanie anomalii morfologicznych u płodów z NIHF. Najczęściej stwierdzano: wady kośćca (n = 3), wady twarzoczaszki (n = 3) oraz wady ośrodkowego układu nerwowego (n = 3). Nieprawidłowy wynik badania genetycznego uzyskano u 6 płodów (60%; wariant patogenny n = 3, wariant potencjalnie patogenny n = 3), w tym u 3 płodów wykryte warianty genetyczne odpowiadały fenotypowi zespołu Noonan. U pozostałych 4 płodów zidentyfikowano warianty o nieznanej patogenności (VUS), które wymagają dalszej interpretacji i potencjalnego powiązania z obrazem klinicznym28 (ryc. 6).
Istnieje kilka wyzwań związanych z interpretacją wyników ES19,20. Choroby o dziedziczeniu jednogenowym mogą charakteryzować się zmienną ekspresją i penetracją, co oznacza, że ta sama mutacja genetyczna może prowadzić do różnych fenotypów klinicznych. Dodatkowo baza danych genetycznych jest ciągle uaktualniana, w związku z czym warianty genetyczne, które obecnie są klasyfikowane jako te o nieznanej patogenności (VOUS – variants of unknown significance), w przyszłości mogą zostać uznane za patogenne na podstawie nowych doniesień naukowych. Ograniczona liczba badań dotyczących prenatalnego wykorzystania ES utrudnia pełne zrozumienie związku między określonymi wariantami genetycznymi a fenotypem NIHF. Rozwój genetyki molekularnej i coraz większa dostępność baz danych wariantów genetycznych pozwalają na bardziej precyzyjną diagnostykę, która z czasem stanie się rutynową częścią diagnostyki prenatalnej19.
Wprowadzenie ES do diagnostyki NIHF znacząco zwiększyło wykrywalność podłoża genetycznego. ES obejmuje jednak jedynie sekwencje kodujące białka, które stanowią zaledwie 1,5-2% całego genomu. Z tego względu diagnostyka oparta wyłącznie na ES może pomijać potencjalnie istotne zmiany genetyczne zlokalizowane w sekwencjach niekodujących.
Sekwencjonowanie genomowe umożliwia szczegółową analizę całego genomu, w tym sekwencji niekodujących. Metoda ta pozwala na wykrycie nie tylko mutacji punktowych, lecz także aberracji strukturalnych, takich jak: insercje, delecje czy zrównoważone translokacje, które mogą być trudne do zidentyfikowania za pomocą aCGH. Ponadto GS pozwala na detekcję sekwencji powtórzonych, które potencjalnie mogą leżeć u podstaw NIHF, a których analiza jest poza zasięgiem ES czy aCGH.
Rycina 7A, B. 23 tydzień ciąży (A) i 32 tydzień ciąży (B); C II, P II. Obrzęk płodu obserwowany od 20 tygodnia ciąży. Łagodna niedokrwistość płodu. Nie stwierdzono wad strukturalnych. Uwagę zwracały ogromny obrzęk tkanki podskórnej, obejmujący twarz, kończyny górne i dolne oraz mosznę, a także znaczne powiększenie wątroby. Od 30 tygodnia ciąży obserwowano wielowodzie. Wynik badania aCGH prawidłowy. Ujemne wyniki badania w kierunku wybranych chorób metabolicznych z płynu owodniowego i badania przesiewowego w kierunku najczęstszych chorób monogenowych z kropli krwi płodu, pobranej na drodze kordocentezy. PPROM w 35 tygodniu ciąży. Zgon okołoporodowy. Za pomocą GS udało się ustalić znany patogenny intronowy wariant w genie PIEZO1 odpowiadający za uogólnioną dysplazję limfatyczną, co odpowiadało obserwowanemu fenotypowi
Dotychczas zastosowanie GS w diagnostyce NIHF zostało opisane w jednym opublikowanym badaniu. Westenius i wsp. oceniali przydatność GS w grupie 23 płodów z NIHF, u których wcześniejsze badania aCGH nie wykazały nieprawidłowości. GS umożliwiło wykrycie nieprawidłowych wariantów genetycznych w 12 przypadkach (53%)29. Warto jednak zauważyć, że analiza w tym badaniu była ograniczona do panelu 281 genów związanych z NIHF, co sugeruje, że pełne wykorzystanie potencjału GS mogłoby dostarczyć jeszcze bardziej szczegółowych danych diagnostycznych. Podczas badań własnych finansowanych z Narodowego Centrum Nauki w ramach grantu naukowego MINIATURA 7 w Klinice Ginekologii i Ginekologii Onkologicznej Centrum Medycznego Kształcenia Podyplomowego w Warszawie przeprowadzono GS u 14 płodów z NIHF o niewyjaśnionej przyczynie. Dotychczas poddano analizie wyniki uzyskane u 7 płodów. U 4 płodów stwierdzono znane patogenne warianty w genach FLNB, PIEZO1 (znany intronowy wariant), CBL, PTPN11, natomiast u 2 płodów wytypowano warianty, które mogą zostać powiązane z obserwowanym fenotypem (IFT122 [intronowy wariant nieobecny dotychczas w bazach], ALPK3, SYNE1). U jednego płodu z wodniakiem karku i nawracającym płynem w opłucnej nie udało się uzyskać żadnych wariantów możliwych do powiązania z zaobserwowanymi objawami klinicznymi (ciąża zakończyła się żywym urodzeniem w 37 tygodniu ciąży). Wyniki GS u pozostałych 7 płodów są w trakcie analizy (dane nieopublikowane) (ryc. 7).