Niewydolność serca
III Klinika Kardiologii SU M, Katowice
Ostre uszkodzenie nerek po operacjach kardiochirurgicznych jako szczególny przypadek zespołu sercowo-nerkowego
Łukasz Krzych,1 Maciej Wybraniec,2 Jerzy Chudek,3 Andrzej Bochenek1
Wprowadzenie
Ostre uszkodzenie nerek (acute kidney injury, AKI) rozwijające się we wczesnym okresie pooperacyjnym stanowi szczególny przypadek zespołu sercowo-nerkowego typu 1. Ocenia się, że u ponad 1/3 pacjentów poddawanych operacjom kardiochirurgicznym oraz u chorych hospitalizowanych z powodu ostrej niewydolności serca dochodzi do upośledzenia czynności nerek o różnym nasileniu. Niewydolność dwóch tak ważnych narządów może prowadzić do rozwoju zespołu niewydolności wielonarządowej, który wiąże się z niekorzystnym rokowaniem oraz zwiększa ryzyko pooperacyjnej chorobowości i śmiertelności. Zasadne zatem wydaje się zaznajomienie lekarzy – zwłaszcza kierujących chorych do zabiegu oraz sprawujących nad nimi opiekę bezpośrednio przed operacją – z dostępnymi metodami zapobiegania, wczesnego rozpoznawania i leczenia ostrego uszkodzenia nerek u pacjentów poddawanych operacjom kardiochirurgicznym.
Epidemiologia
Ostra niewydolność nerek jest klinicznie istotnym interdyscyplinarnym problemem, który w proces diagnostyczno-terapeutyczny angażuje lekarzy wielu specjalności. Nagłe upośledzenie czynności nerek, nazywane zgodnie z obowiązującą nomenklaturą ostrym uszkodzeniem nerek, znacznie pogarsza wyniki leczenia pacjentów poddawanych różnym procedurom inwazyjnym [1], zwłaszcza operacjom kardiochirurgicznym (cardiac surgery-associated acute kidney injury, CSA-AKI). U 24-45% chorych hospitalizowanych z powodu ostrej niewydolności serca dochodzi do upośledzenia czynności nerek o różnym nasileniu, a wśród pacjentów poddawanych operacjom kardiochirurgicznym częstość tego powikłania sięga aż 40% [2,3] (a nawet 68% w grupie pacjentów po przeszczepieniu serca [4]). Jak wynika z powyższych danych, częstość występowania AKI jest porównywalna wśród pacjentów poddawanych operacjom kardiochirurgicznym i chorych przyjmowanych na oddział kardiologii z powodu ostrej niewydolności serca (najczęściej wtórnej do ostrego zespołu wieńcowego) lub zaostrzenia przewlekłej niewydolności serca o różnej etiologii. Wystąpienie CSA-AKI wiąże się z wydłużeniem czasu hospitalizacji, zwłaszcza na oddziale intensywnej terapii, stanowi niezależny czynnik ryzyka rozwoju przewlekłej choroby nerek (chronic kidney disease, CKD) [1] i zwiększa pooperacyjne ryzyko zgonu, które zależy od czasu utrzymywania się uszkodzenia nerek: dla trwającego 1-2 dni iloraz zagrożeń [HR] wynosi 1,66 (95% przedział ufności [PU] 1,32-2,09), a dla trwającego powyżej 7 dni – 3,40 (95% PU 2,73-4,25) [2,5]. Udokumentowano, że pogorszenie czynności nerek u pacjentów leczonych zachowawczo jest niezależnym czynnikiem ryzyka ponownego przyjęcia do szpitala z powodu zaostrzenia niewydolności serca i, co szczególnie istotne, ryzyka zgonu, niezależnie od czasu utrzymywania się tej patologii (HR=1,47, 95% PU 1,13-1,81, p=0,02) [6]. Ryzyko zgonu jest największe u osób wymagających leczenia nerkozastępczego (OR=3,82, 95% PU 3,44-4,25) [7].
Zespół sercowo-nerkowy
Na uwagę zasługuje to, że posługujemy się tutaj pojęciem uszkodzenia, co wskazuje na jego zewnętrzny (wtórny) charakter. Wynika to z pozycji nozologicznej CSA-AKI, należącego do typu 1 zespołu sercowo-nerkowego (cardio-renal syndrome, CRS) [8], którego spójna klasyfikacja została niedawno zaproponowana przez Ronco i wsp. (tab. 1) [9]. W typie 1 ostra niewydolność serca, obejmująca również tzw. zespół małego rzutu po operacjach kardiochirurgicznych, prowadzi do ostrego upośledzenia czynności nerek. Obniżona kurczliwość mięśnia sercowego, uraz operacyjny, zwiększona utrata krwi i hipowolemia prowadzą do spadku pojemności minutowej i zmniejszenia nerkowego przepływu krwi [10]. Zastój krwi żylnej w nerkach jest efektem redystrybucji krwi do układu naczyń żylnych, wynikającej ze spadku efektywnej objętości krwi tętniczej [8]. Za dodatkowy czynnik uszkadzający uważa się konieczność stosowania leków nefrotoksycznych, takich jak niesteroidowe leki przeciwzapalne (non-steroidal anti-inflammatory drugs, NSAID), inhibitory konwertazy angiotensyny (angiotensin-converting enzyme inhibitor, ACE-I) i diuretyki oraz użycie radiologicznych środków kontrastowych (angiografia, w tym naczyń wieńcowych, tomografia komputerowa). Nie należy zapominać również o roli krążenia pozaustrojowego, które sprzyja hipoperfuzji nerek i rozwojowi zespołu ogólnoustrojowej odpowiedzi zapalnej w wyniku kontaktu komórek odpornościowych i białek osocza z ujemnie naładowaną wewnętrzną powierzchnią drenów, pompy perystaltycznej i błony oksygenatora [11].
Mechanizmy prowadzące do rozwoju AKI to przede wszystkim: 1) niedokrwienie, do którego dochodzi podczas zatrzymania krążenia i uszkodzenie rdzenia nerki w okresie reperfuzji, 2) niskie ciśnienie perfuzyjne w okresie okołooperacyjnym, spowodowane przejściowym zwężeniem lub zamknięciem tętnic nerkowych w przebiegu odruchowego skurczu naczynia, stosowania nadmiernych dawek leków naczynioskurczowych, mikro- i makrozatorowości, niedokrwistości i hipoksemii, 3) wpływ toksyn endo- i egzogennych (w tym leków) oraz 4) związany z zabiegiem lub jego powikłaniami stan zapalny miejscowy i ogólnoustrojowy (zespół uogólnionej odpowiedzi zapalnej, zakażenia, posocznica), stres oksydacyjny oraz modulacja odpowiedzi immunologicznej w odpowiedzi na krążenie pozaustrojowe i uraz chirurgiczny [12]. Mnogość przyczyn prowadzących do CSA-AKI uzasadnia klasyfikowanie tego powikłania jako CRS typu 5 w przypadkach jednoczesnego uszkodzenia serca i nerek.
Definicja CSA-AKI
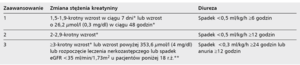
Jest kilka definicji AKI [13], które doczekały się wielu modyfikacji. W niedawno opublikowanych wytycznych komitetu KDIGO (Kidney Disease: Improving Global Outcomes) zaproponowano ujednolicony schemat rozpoznawania AKI (tab. 2) [14], który bierze pod uwagę bezwzględny wzrost stężenia kreatyniny o ponad 26,2 µmol/l (0,3 mg/dl) w czasie 48 godzin od zabiegu, a także względny przyrost kreatyninemii o 50% w porównaniu z wyjściowym stężeniem w okresie 7 dni. Dodatkowym kryterium uzasadniającym rozpoznanie AKI jest zmniejszenie wydalania moczu poniżej 30 ml na godzinę przez kolejne 6 godzin (dla pacjenta o masie 60 kg).
Czynniki ryzyka CSA-AKI
Świadomość znaczenia ostrego uszkodzenia nerek i znajomość czynników predysponujących do wystąpienia CSA-AKI pozwala usprawnić proces wstępnej kwalifikacji do operacji kardiochirurgicznych, zaoszczędzić pacjentom stresu związanego z ewentualną dyskwalifikacją od leczenia chirurgicznego bezpośrednio przed zabiegiem, a także zaoferować wybranym chorym inne metody postępowania (np. przezskórną interwencję wieńcową lub leczenie zachowawcze). Jednak w wybranych sytuacjach klinicznych wiedza o potencjalnym zagrożeniu CSA-AKI w przypadku konieczności przeprowadzenia zabiegu ułatwia przede wszystkim odpowiednie przedoperacyjne przygotowanie pacjentów w celu zminimalizowania ryzyka wystąpienia tego powikłania. Decydująca wydaje się zatem prewencja CSA-AKI: dokładna kwalifikacja do operacji przez wielodyscyplinarny zespół (tzw. heart team), odpowiednie przygotowanie przedoperacyjne i jak najwcześniejsze wdrożenie terapii w oparciu o wymienione wcześniej precyzyjne kryteria diagnostyczne.
Wystąpieniu AKI sprzyja zaawansowany wiek, cukrzyca, nadciśnienie tętnicze, kardiomiopatia (niezależnie od jej etiologii), miażdżyca naczyń obwodowych, przewlekła obturacyjna choroba płuc i palenie tytoniu [12]. Niebagatelne znaczenie ma także wyjściowo zwiększone stężenie kreatyniny w surowicy, nawet przy braku chorób towarzyszących [15,16]. Parametr ten znalazł zastosowanie w ocenie ryzyka operacyjnego. Szacowany na jego podstawie wskaźnik przesączania kłębuszkowego (estimated glomerular filtration rate, eGFR) jest rutynowo brany pod uwagę przy kwalifikacji chorych do operacji kardiochirurgicznych i stanowi element powszechnie używanej skali EuroSCORE (European System for Cardiac Operative Risk Evaluation) [17].
Procedurami okołooperacyjnymi, które mogą przyczynić się do upośledzenia czynności nerek, są: konieczność przetoczenia koncentratu krwinek czerwonych (z powodu niedokrwistości), śródoperacyjne zastosowanie leków o działaniu inotropowo dodatnim (z powodu pogorszenia funkcji serca), poprawiających perfuzję naczyniową (z powodu spadku oporu obwodowego) i antyarytmicznych (z powodu zaburzeń rytmu upośledzających wydolność hemodynamiczną). Ważnym czynnikiem rozwoju CSA-AKI jest również czas zakleszczenia aorty oraz konieczność ponownego zastosowania krążenia pozaustrojowego (jako wykładników czasu trwania operacji i ewentualnych powikłań ze strony układu krążenia) [16]. Operacje zastawkowe oraz procedury złożone obarczone są większym prawdopodobieństwem rozwoju AKI niż elektywne pomostowanie aortalno-wieńcowe [18]. Powyższe czynniki ryzyka powinny być uwzględniane w pooperacyjnej ocenie chorych poddawanych operacjom kardiochirurgicznym, a u pacjentów zagrożonych rozwojem powikłania czynność nerek powinna być często i rzetelnie monitorowana.
Monitorowanie
Uwzględnione w definicji oznaczenie stężenia kreatyniny nie stanowi niestety wczesnego wykładnika CSA-AKI. Przyjęte 48-godzinne okno diagnostyczne nie jest kryterium arbitralnym, ale uwarunkowanym charakterystyką oznaczenia stężenia kreatyniny jako markera AKI. Do wzrostu kreatyninemii dochodzi najczęściej dopiero po 5 dniach od zadziałania na nefron czynnika uszkadzającego, nie wcześniej jednak niż po 24-48 godzinach [9,19]. Mimo szybkiego spadku wskaźnika przesączania kłębuszkowego stężenie kreatyniny w pierwszych dobach pozostaje na stałym poziomie, co wynika z wykładniczej zależności między tymi dwoma parametrami. Paradoksalnie w pierwszych 24 godzinach po operacji często obserwuje się spadek stężenia kreatyniny związany z śródoperacyjną hemodylucją [13]. Pooperacyjna stopniowa hemokoncentracja może mylnie sugerować wzrost stężenia kreatyniny i postępujące uszkodzenie nerek. Ograniczeniem metody jest również konieczność interpretacji stężenia kreatyniny z uwzględnieniem czynników wpływających na ten parametr, czyli wieku, płci i całkowitej masy mięśniowej. W świetle powyższych faktów coraz częściej postuluje się konieczność znalezienia nowego wczesnego markera AKI [19]. Dobrym kandydatem wydaje się białko lipokalina neutrofilowa związana z żelatynazą (neutrophil gelatinase-associated lipocalin, NGAL), które wykazuje ekspresję w komórkach kanalików nerkowych i pełni rolę w mechanizmie odporności nieswoistej. Udokumentowano, że do wzrostu stężenia NGAL w surowicy dochodzi już po 1-2 godzinach (punkt odcięcia: 190 ng/ml), a w moczu po 4-6 godzinach od pojawienia się zmian patogenetycznych w nerkach (norma: 20,5 ng/ml) [20-22]. Wczesny przedoperacyjny wzrost stężenia NGAL w surowicy lub moczu aż pięciokrotnie zwiększa ryzyko wystąpienia CSA-AKI, definiowanego jako wzrost stężenia kreatyniny w okresie późniejszym [1]. Oznaczenie stężenia NGAL ma również przewagę nad kreatyniną, ponieważ odzwierciedla proces zapalny w czasie rzeczywistym [23] i stanowi czuły wykładnik AKI w przypadkach wyjściowo (przedoperacyjnie) zwiększonego stężenia kreatyniny (AKI nałożone na przewlekłą niewydolność nerek).
Zapobieganie CSA-AKI

Tabela 3. Metody zapobiegania ostremu uszkodzeniu nerek po operacjach kardiochirurgicznych [14,24,25]
Nie opracowano dotychczas metod wczesnego wykrywania CSA-AKI, zatem jego leczenie stanowi wciąż jedno z wyzwań współczesnej intensywnej terapii kardiochirurgicznej. Dlatego nacisk kładzie się przede wszystkim na zapobieganie jego wystąpieniu przez dyskwalifikację lub odroczenie operacji u chorych zagrożonych AKI, u których zabieg nie musi być przeprowadzony ze wskazań życiowych. Kluczowa wydaje się ocena obecności czynników ryzyka na podstawie wywiadu, badania przedmiotowego, badań laboratoryjnych i obrazowych (tab. 3). Prawidłową kwalifikację przedoperacyjną może zapewnić jedynie interdyscyplinarny zespół lekarski, w skład którego wchodzić powinien nie tylko kardiochiurg, kardiolog (również inwazyjny) i anestezjolog, ale także m.in. nefrolog, diabetolog i geriatra.