Kolejnym krokiem powinno być zapewnienie choremu odpowiedniego bilansu płynowego przed operacją, co jest szczególnie istotne u pacjentów z zastoinową niewydolnością serca. Zbyt intensywne odwadnianie chorych przed operacją może przynieść katastrofalne skutki. Podczas zabiegu należy unikać gwałtownych zmian wolemii i ciśnienia tętniczego – trzeba kontrolować nawadnianie dożylne i stosowanie diuretyków w oparciu o ciągłe monitorowanie hemodynamiczne ciśnienia tętniczego i ośrodkowego ciśnienia żylnego (central venous pressure, CVP) [24] oraz bioimpedancji (pomiar całkowitej zawartości wody w ustroju przez pomiar wektora bioimpedancji), jeśli to możliwe [25,26].
Niezbędna jest także ścisła kontrola glikemii w okresie okołooperacyjnym, zwłaszcza u pacjentów z wcześniej rozpoznaną cukrzycą. W wytycznych KDIGO za docelowe uznaje się stężenie glukozy w zakresie 110-149 mg/dl [14].
Aktualne zalecenia diabetologiczne sugerują jednak mniej restrykcyjną terapię hiperglikemii pooperacyjnej (utrzymywanie wartości w granicach 140-180 mg/dl) z uwagi na ryzyko rozwoju hipoglikemii [27].
Śródoperacyjna podaż masy erytrocytarnej koreluje z ryzykiem wystąpienia CSA-AKI, nie ustalono jednak dotychczas, czy bardziej szkodliwy jest wpływ samej niedokrwistości, czy raczej przetoczenia i związanej z nim immunizacji. CSA-AKI występuje prawie dwukrotnie częściej u chorych, u których stężenie hemoglobiny przed operacją wynosi <12,5 g/dl, co potwierdza tylko ważność właściwego przygotowania do operacji [28]. Rozsądne wydaje się, że po operacji należy korygować niedokrwistość, przetaczając koncentrat krwinek czerwonych, gdy stężenie hemoglobiny spada poniżej 7 g/dl lub hematokryt poniżej 21% [14].
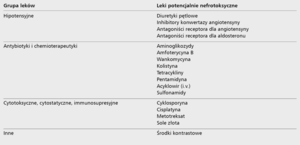
Złotym standardem opieki nad pacjentami, u których istnieje ryzyko upośledzenia czynności nerek, jest odstawienie kilka dni przed operacją leków potencjalnie nefrotoksycznych. Należy unikać jakichkolwiek niesteroidowych leków przeciwzapalnych [29], a także paracetamolu [30]. NSAID jako niewybiórcze inhibitory cyklooksygenazy COX-1 i COX-2 prowadzą do zmniejszenia stężenia prostacykliny w tętnicach prostych, co skutkuje niedokrwieniem rdzenia nerki.
W obliczu pogorszenia czynności nerek po operacji klinicyści stają przed koniecznością dostosowania dawek leków niezbędnych w terapii niewydolności krążenia, ale jednocześnie o działaniu nefrotoksycznym. ACE-I skutecznie obniżają ciśnienie i w długoterminowej obserwacji zapobiegają niekorzystnej przebudowie mięśnia sercowego oraz znoszą efekty aktywacji neurohumoralnej (wzrost wydzielania reniny, wazopresyny i amin katecholowych), co zapobiega dalszemu niedokrwieniu nerek [8]. Z drugiej strony spadek ciśnienia tętniczego sprzyja zmniejszeniu perfuzji narządowej, a wyniki badań epidemiologicznych wykazały także, że przedoperacyjne przyjmowanie ACE-I wiąże się z niewielkim, choć istotnym statystycznie ryzykiem rozwoju dysfunkcji nerek (iloraz szans [OR] 1,36, 95% PU 1,1-1,67) [31]. Biorąc pod uwagę powyższe dane, uważa się, że ACE-I nie powinny być rutynowo odstawiane, a tylko dawka leku wymaga dostosowania do aktualnego stężenia kreatyniny i diurezy [32], nawet za cenę spadku GFR związanego ze zmniejszeniem napięcia tętniczki odprowadzającej. W takiej sytuacji konieczne jest częstsze niż zwykle monitorowanie laboratoryjnych parametrów funkcji nerek oraz stężenia elektrolitów, ze szczególnym uwzględnieniem jonów potasu [33].
Diuretyki pętlowe mogą nasilać przednerkowy komponent ostrego uszkodzenia nerek, a także aktywować kanalikowo-kłębuszkowe sprzężenie zwrotne, co może prowadzić do dalszego niedokrwienia nerki [34]. Dlatego nie powinno się ich stosować w zapobieganiu ostrego uszkodzenia nerek u pacjentów z prawidłowym bilansem płynowym. Dyskusyjne jest także stosowanie terapii odwadniającej u stabilnych chorych z zastoinową niewydolnością krążenia przed operacją. W przypadku przewodnienia ich użycie jest wskazane w celu odwrócenia niekorzystnej redystrybucji płynu ustrojowego do łożyska żylnego [14], choć zawsze należy zachować równowagę między ryzykiem dekompensacji krążenia a zbyt rygorystycznym reżimem płynowym skutkującym rozwojem AKI.
U każdego pacjenta należy ograniczyć podaż jonowych środków kontrastowych, które często stosowane są podczas wykonywanych przed operacją angiografii naczyń wieńcowych lub angio-TK, niezbędnych do oceny wskazań do leczenia kardiochirurgicznego [35]. Podobne znaczenie ma ograniczenie badań obrazowych bezpośrednio po operacji (1-2 dni). Ryzyko rozwoju AKI u chorych, u których w trakcie jednej hospitalizacji wykonano koronarografię, a następnie operację serca jest o 54% większe niż u chorych, którym nie podawano środków kontrastowych [36].
Leczenie CSA-AKI
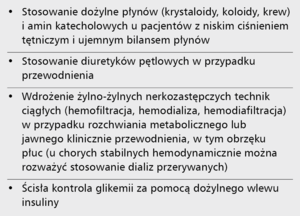
Najważniejszym celem postępowania jest wczesne rozpoznanie rozwijającego się AKI, dlatego niezbędne jest monitorowanie stężenia kreatyniny w osoczu, diurezy godzinowej oraz ewentualne oznaczenie nowych markerów uszkodzenia nerek, takich jak NGAL [1]. W przypadku wzrostu stężenia kreatyniny lub spadku diurezy godzinowej spełniających kryteria KDIGO, należy niezwłocznie wdrożyć leczenie przywracające równowagę hemodynamiczną i wodno-elektrolitową ustroju. Warto jeszcze raz podkreślić, że kluczowe jest odstawienie wszelkich potencjalnie nefrotoksycznych leków (tab. 4) [29,30,37-40]. U chorych z niskim ciśnieniem tętniczym konieczna jest jednoczesna dożylna podaż płynów i ewentualnie stosowanie amin presyjnych (tab. 5). Należy nadmienić, że nie zaleca się już stosowania dopaminy w dawce 0,5-2 µg/kg/min w celu poprawy ukrwienia nerek (tzw. dawka diuretyczna) [14]. Diuretyki pętlowe należy stosować u pacjentów z hiperwolemią w dawce dostosowanej do ciśnienia tętniczego, bioimpedancji, ośrodkowego ciśnienia żylnego i stężenia biomarkerów wydolności nerek (np. NGAL) – tzw. terapia 5B (balance of fluids, blood pressure, blood volume, biomarkers, bioimpedance) [26]. Gdy stan kliniczny się pogarsza i dochodzi do destabilizacji metabolicznej pod postacią kwasicy, hiperkaliemii, mocznicy lub przewodnienia skutkującego rozwojem obrzęku płuc, należy niezwłocznie wdrożyć techniki nerkozastępcze, przede wszystkim ciągłe (continuous renal replacement therapy, CRRT) [41]. Obecnie trwa randomizowane badanie CARRESS-HF (Cardiorenal Rescue Study in Acute Decompensated Heart Failure) porównujące podejście farmakologiczne (diuretyki i nawadnianie dożylne) oraz nerkozastępcze techniki ciągłe [42]. Wydaje się jednak, że w miarę możliwości technicznych CRRT powinno być stosowane w razie wystąpienia ewidentnych wskazań klinicznych, co pozwoli pacjentom przetrwać okres utraty funkcji nerek aż do jej powrotu, np. już w przypadku pojawienia się poliurycznej fazy niewydolności nerek.
Podsumowanie
Ostre uszkodzenie nerek po operacjach kardiochirurgicznych jest modelowym przykładem zespołu sercowo-nerkowego typu 1. Chociaż pozornie temat dotyczy lekarzy anestezjologów i kardiochirurgów zajmujących się wczesną opieką pooperacyjną, w odpowiedniej kwalifikacji chorego i właściwym przygotowaniu do zabiegu powinni brać udział lekarze wszystkich specjalności. Pomaga w tym znajomość czynników ryzyka wystąpienia tego powikłania oraz zasad modyfikacji stosowanego dotychczas leczenia farmakologicznego w wybranych przypadkach. Obecnie duże nadzieje wiąże się z możliwością rutynowego stosowania wczesnych markerów AKI, takich jak NGAL. Odpowiednio wczesna diagnostyka i skuteczna interwencja terapeutyczna powinny pozwolić na odwrócenie niekorzystnej sekwencji zdarzeń patogenetycznych prowadzącej do postępującego ostrego uszkodzenia nerek.