Techniką obrazową z wyboru w diagnostyce AAS jest tomografia komputerowa. W przeciwieństwie do technik echokardiograficznych wielorzędowa angio-TK pozwala na wizualizację całej aorty wraz z dużymi tętnicami, precyzyjnie lokalizuje typ i miejsce patologii aorty oraz identyfikuje narządy zagrożone niedokrwieniem i daje możliwość rekonstrukcji w celu zaplanowania zabiegu naprawczego (ryc. 6, 7).
Wysoką wartość diagnostyczną ma również rezonans magnetyczny, dający możliwość jeszcze lepszej rekonstrukcji anatomii aorty i patologicznej zmiany [24]. Ograniczeniem jest jednak dostępność, koszt i długi czas badania, nie do zaakceptowania w ciężkim objawowym stanie chorego.
Leczenie
Zasadniczym elementem determinującym strategię terapeutyczną jest zajęcie aorty wstępującej (typ A wg klasyfikacji Stanford). IMH i AD z zajęciem aorty wstępującej są wskazaniami do pilnej interwencji chirurgicznej. Zmiany typu B wg klasyfikacji Stanford można leczyć zachowawczo, jeżeli nie ma cech niedokrwienia kończyn i/lub narządów, cech wynaczynienia krwi poza światło aorty, progresji dyssekcji, niekontrolowanego bólu, czy też wysokich wartości ciśnienia tętniczego nieulegających normalizacji [19].
Podstawą leczenia farmakologicznego chorego z AAS jest kontrola ciśnienia tętniczego. Sugeruje się docelowe wartości ciśnienia tętniczego skurczowego na poziomie 100-120 mm Hg, redukcję ciśnienia tętna i częstości akcji serca do 60-80/min. Zalecanym lekiem do uzyskania kontroli ciśnienia tętniczego jest labetalol lub metoprolol podawane dożylnie. Dodatkowo zaleca się leki opioidowe w celu kontroli bólu i obniżenia wydzielania katecholamin [2].
Jak wspomniano, strategia interwencyjna zależy od zajęcia aorty wstępującej. Podstawowym sposobem leczenia AAS w typie A jest wczesna interwencja chirurgiczna. W ciągu pierwszych 48 godzin u osób nieleczonych chirurgicznie śmiertelność wzrasta o 1-2% na godzinę. Śmiertelność okołooperacyjna u chorych leczonych chirurgicznie wynosi nadal około 10-30%, jednak jest to istotnie lepszy wynik niż 50% śmiertelność u chorych leczonych wyłącznie farmakologicznie [3]. Ze względu na ograniczenia anatomiczne interwencja endowaskularna w tym typie AAS nie jest aktualnie polecana.
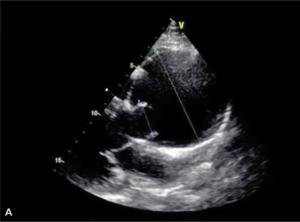
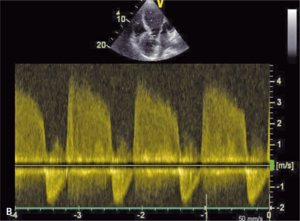
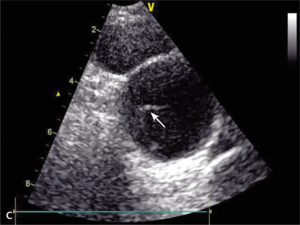
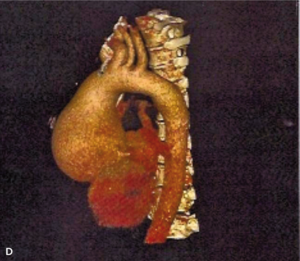
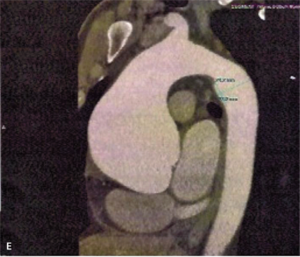
Rycina 8. [A] Poszerzenie aorty wstępującej do 84 mm w TTE. [B] Ciężka niedomykalność aortalna. [C] Rozwarstwienie błony wewnętrznej w TTE. [D, E] Znaczne poszerzenie aorty wstępującej w TK.
AAS w obrębie aorty zstępującej nie wymaga pilnego zabiegu, jeśli nie wystąpiły wymienione wyżej powikłania i czynniki dodatkowe. Stabilna klinicznie i radiologicznie zmiana może być leczona zachowawczo [25]. Pozostaje jednak problem identyfikacji rzeczywiście stabilnych zmian. O ile prawdopodobieństwo pęknięcia aorty w AD typu B jest stosunkowo niewielkie (4-8%) [26], to w IMH i PAU ten odsetek może wynosić nawet 35-50% [27]. Klasyczne zabiegi chirurgiczne w AAS typu B – szczególnie w ostrej fazie – niosą ze sobą wysokie ryzyko okołooperacyjne [28]. Jednocześnie zstępujący odcinek aorty w wielu przypadkach stwarza dogodne możliwości leczenia endowaskularnego (endovascular aortic repair, EVAR) z dużym odsetkiem (96-100%) skutecznych zabiegów [29] przy małym odsetku powikłań. Stosowanie stentgrafów w AD pozwala zamknąć wrota rozwarstwnienia. Rzadko jednak doprowadza do wykrzepienia całego kanału rzekomego w szczególności, gdy rozwarstwienie przechodzi na aortę brzuszną i tętnice biodrowe. O ile chory z powikłaną dyssekcją typu B będzie pacjentem wysokiego ryzyka powikłań dyssekcji, w dużym odsetku przypadków odniesie korzyść z EVAR, to dyskusyjne pozostaje leczenie endowaskularne stabilnego przewlekłego rozwarstwienia aorty. Normalizacja ciśnienia, obserwacja pacjenta, innymi słowy leczenie zachowawcze, pozostaje jednym z uznanych sposobów leczenia w tych przypadkach. Obok powikłanej dyssekcji typu B czy też ostrej lub podostrej dyssekcji wysokiego ryzyka powikłań leczenie endowaskularne znajduje zastosowanie również w leczeniu innych patologii mieszczących się w pojęciu ostrego zespołu aortalnego. W IMH i PAU, ze względu na ich ograniczoną lokalizację (zwłaszcza PAU), stentgrafty spełniają swoją funkcję, zapobiegając potencjalnemu pęknięciu lub progresji do AD.
Podsumowanie
Koncepcja stworzenia pojęcia AAS to stosunkowo nowe podejście do starego problemu, który wcześniej zwykle utożsamiany był z pękającym tętniakiem aorty lub jej rozwarstwieniem. W diagnostyce różnicowej ostrego bólu w klatce piersiowej AAS zawsze powinien być brany pod uwagę obok ACS i APE. Z pomocą mogą przyjść badania podstawowe: brak zmian w EKG, prawidłowe stężenia troponin, ale podwyższone D-dimerów przy braku czynników ryzyka zatorowości płucnej i przeciążenia prawej komory w TTE mogą sugerować AAS. Badanie echokardiograficzne może być pomocne w stwierdzeniu proksymalnej dyssekcji, jednak rozstrzygającym badaniem jest angio-TK. W zależności od lokalizacji zmiany, ale też od nasilenia dolegliwości oraz objawów współistniejących należy wybrać optymalne postępowanie. W AAS typu A jest to pilne leczenie chirurgiczne, podczas gdy w typie B – zazwyczaj leczenie zachowawcze i endowaskularne.
Przypadek 1
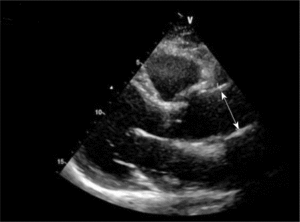
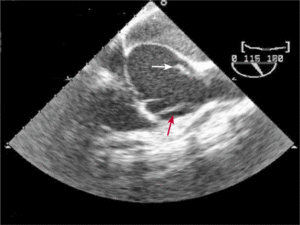
Mężczyzna, lat 46, z wywiadem w kierunku nadciśnienia tętniczego został przyjęty w powodu utrzymujących się od kilku dni dolegliwości bólowych w klatce piersiowej o umiarkowanym nasileniu. W izbie przyjęć ciśnienie tętnicze wynosiło 130/45 mm Hg, w EKG nie stwierdzono zmian, a TnT była ujemna. W badaniu echokardiograficznym wykonanym przy przyjęciu uwidoczniono tętniaka aorty wstępującej o średnicy 84 mm z ciężką niedomykalnością aortalną (ryc. 8A, B). Widoczne było rozwarstwienie ściany powyżej opuszki aorty (ryc. 8C).
Po potwierdzeniu rozpoznania w tomografii komputerowej (ryc. 8D, E) oraz stwierdzeniu prawidłowych tętnic wieńcowych w angio-TK chory został zakwalifikowany do pilnego zabiegu kardiochirurgicznego. Wykonano plastykę zastawki aortalnej z wszczepieniem nadopuszkowym protezy aortalnej. Rycina 9 przedstawia obraz badania echokardiograficznego po zabiegu.
Przypadek 2
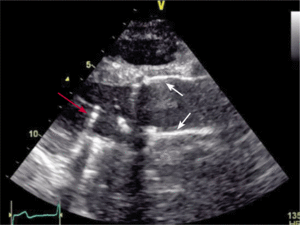
Kobieta 53-letnia, z wszczepioną w 1995 roku sztuczną zastawką mitralną, została przekazana ze szpitala rejonowego do oddziału kardiochirurgii we wstrząsie kardiogennym. Dwa dni wcześniej została przyjęta do ośrodka kierującego ze świeżym zawałem ściany dolnej mięśnia sercowego – wykonano angioplastykę prawej tętnicy wieńcowej z implantacją stentu. Po zabiegu stan chorej pogorszył się. W tomografii komputerowej uwidoczniono rozwarstwienie na całej długości aorty wstępującej i zstępującej. Chorą operowano w trybie pilnym. Rycina 10 przedstawia obraz w TEE przedoperacyjnym na bloku operacyjnym, a rycina 11 – obraz TTE po zabiegu operacyjnym (wymiana aorty z implantacją sztucznej zastawki ATS 29 + CABG AoRCA).