Ocena żywotności mięśnia sercowego w praktyce klinicznej
lek. Dawid Miśkowiec
prof. dr hab. n. med. Piotr Lipiec
Ocena żywotności mięśnia sercowego odgrywa dużą rolę w praktyce klinicznej, zwłaszcza w przypadku pacjentów z przewlekłą niewydolnością serca o etiologii niedokrwiennej. Do jej przeprowadzenia wykorzystuje się obecnie kilka metod obrazowania, m.in. techniki echokardiograficzne, rezonans magnetyczny z oceną późnego wzmocnienia pokontrastowego oraz techniki radioizotopowe. Ich użyteczność i wartość diagnostyczna zostały potwierdzone w licznych badaniach, ale są też ograniczenia utrudniające/uniemożliwiające zastosowanie tych technik w codziennej praktyce.
Wprowadzenie – definicje
Ocena żywotności mięśnia sercowego ma duże znaczenie dla odpowiedniego zaplanowania procesu terapeutycznego, dostarcza też informacji na temat rokowania. Odróżnienie żywotnego mięśnia sercowego od nieodwracalnej martwicy jest niezbędne, aby podjąć decyzję o rewaskularyzacji u pacjentów z rozpoznaną chorobą wieńcową oraz współistniejącymi zaburzeniami kurczliwości lewej komory (przewlekła niewydolność serca o etiologii niedokrwiennej). Pozwala również na selekcję grupy chorych, u których zabieg może poprawić rokowanie.
Żywotność mięśnia sercowego definiowana jest zazwyczaj jako zachowanie strukturalnej integralności miokardium, umożliwiające podjęcie funkcji skurczowej. Ocena żywotności mięśnia sercowego najczęściej dotyczy segmentów, które nie wykazują spoczynkowej funkcji skurczowej. Tego typu zaburzenia mogą bowiem występować zarówno w obrębie mięśnia martwego, jak i mięśnia sercowego o zachowanej żywotności. Dzieje się tak na drodze jednego z dwóch mechanizmów: zamrożenia (hibernacji) lub ogłuszenia mięśnia sercowego. W przeciwieństwie do obszaru mięśnia sercowego objętego martwicą utrata funkcji skurczowej w obrębie żywotnego mięśnia sercowego jest potencjalnie odwracalna.1,2
Ogłuszenie to stan obszaru mięśnia sercowego, w którym w wyniku ostrego epizodu niedokrwiennego (wynikającego najczęściej z zamknięcia tętnicy wieńcowej) dochodzi do przedłużonej, lecz przejściowej dysfunkcji skurczowej. Aby mówić o ogłuszonym miokardium, muszą zostać spełnione dwa warunki. Po pierwsze dysfunkcja skurczowa w obszarze ogłuszonego mięśnia sercowego musi być całkowicie odwracalna, po drugie – dysfunkcja ta utrzymuje się pomimo przywrócenia prawidłowej lub prawie prawidłowej perfuzji wieńcowej przez dotknięty nią obszar mięśnia sercowego.3
Stany, w których może nastąpić ogłuszenie mięśnia sercowego, to m.in.: skuteczna reperfuzja naczynia wieńcowego w przebiegu ostrych zespołów wieńcowych, stan po epizodzie ostrego niedokrwienia wywołanego wzrostem obciążenia (pacjenci z chorobą niedokrwienną serca lub znacznym przerostem mięśnia sercowego), stan po nagłym zatrzymaniu krążenia czy po przeszczepie serca. Obszary ogłuszonego mięśnia sercowego obserwuje się również na pograniczu stref objętych martwicą w przebiegu ostrego zawału mięśnia sercowego. Przywrócenie funkcji skurczowej ogłuszonego miokardium następuje zazwyczaj spontanicznie w ciągu od kilku godzin do kilku tygodni od wystąpienia epizodu ostrego niedokrwienia.4
Zaproponowano kilka teorii tłumaczących mechanizmy patofizjologiczne ogłuszenia mięśnia sercowego, wśród których najważniejsze wydają się teorie zakładające udział wolnych rodników, degradację troponiny I oraz przeładowanie miocytów wapniem połączone ze zmniejszoną wrażliwością miofilamentów na wapń w obszarze objętym niedokrwieniem.5
Hibernacją (zamrożeniem) mięśnia sercowego określany jest stan przewlekłego niedokrwienia, prowadzący do odwracalnego upośledzenia funkcji skurczowej miokardium. Zamrożenie następuje na skutek zmniejszonego przepływu wieńcowego, a zredukowana funkcja skurczowa pozwala zachować komórkom mięśnia sercowego żywotność w warunkach zredukowanej podaży tlenu i umożliwia powrót prawidłowej lub prawie prawidłowej funkcji po przywróceniu warunków prawidłowego przepływu wieńcowego.2,6 Pierwotna (zoologiczna) geneza tego pojęcia wskazywała na adaptację miokardium (poprzez redukcję wydatków energetycznych) do warunków obniżonej podaży tlenu i substratów energetycznych w niedokrwionym obszarze. Współcześnie uważa się jednak, że zamrożenie mięśnia sercowego może wystąpić również u pacjentów z istotnym zwężeniem tętnic wieńcowych pomimo prawidłowego lub prawie prawidłowego spoczynkowego przepływu wieńcowego. W tym przypadku kluczową rolę mają odgrywać zmniejszenie rezerwy wieńcowej oraz nawracające epizody niedokrwienne, skutkujące nawracającymi epizodami ogłuszenia.7 Najważniejszym elementem definicji zamrożonego (hibernowanego) mięśnia sercowego jest odwracalność jego dysfunkcji skurczowej po rewaskularyzacji. Poprawa funkcji skurczowej zależy od tego, jak długo trwała hibernacja, i następuje zazwyczaj od kilku godzin do kilkunastu miesięcy po zrewaskularyzowaniu niedokrwionego obszaru.1,8
Znaczenie oceny żywotności mięśnia sercowego w praktyce klinicznej
Ocena żywotności mięśnia sercowego ma szczególne znaczenie u pacjentów z przewlekłą niewydolnością serca o etiologii niedokrwiennej, pozwala bowiem na wyselekcjonowanie chorych, którzy mogą odnieść istotne korzyści z rewaskularyzacji.9 Allman i wsp. przeprowadzili metaanalizę podsumowującą wyniki 24 badań dotyczących żywotności mięśnia sercowego i stwierdzili, że wykonanie rewaskularyzacji u pacjentów z przewlekłą dysfunkcją skurczową lewej komory na podłożu choroby niedokrwiennej z zachowaną żywotnością miokardium wiąże się z blisko 80-procentową redukcją rocznej śmiertelności w porównaniu ze strategią leczenia zachowawczego, podczas gdy rewaskularyzacja w przypadku braku zachowanej żywotności nie ma istotnego wpływu na śmiertelność.10 Z drugiej strony wyniki wieloośrodkowego badania STICH (Surgical Treatment for Ischemic Heart Failure) przeprowadzonego w latach 2002-2007, w którym dokonywano oceny żywotności za pomocą echokardiografii dobutaminowej i/lub tomografii emisyjnej pojedynczego fotonu (SPECT – single photon emission computed tomography), podważyły znaczenie oceny żywotności w podejmowaniu decyzji terapeutycznych. Pomimo że w analizie jednoczynnikowej wykazano istotnie wyższą przeżywalność pacjentów z zachowanym żywotnym miokardium poddanych pomostowaniu aortalno-wieńcowemu (CABG – coronary artery bypass grafting), po skorygowaniu o inne zmienne zakłócające, wynikające z wyjściowej różnicy w charakterystyce badanych podgrup, nie zaobserwowano istotnych różnic w rokowaniu. Na podstawie tych wyników autorzy wywnioskowali, że ocena żywotności nie pozwala wyselekcjonować pacjentów, którzy mogą odnieść korzyści z CABG.11 Trzeba jednak podkreślić, że badanie STICH miało istotne ograniczenia metodologiczne. Oceny żywotności dokonywano bowiem różnymi technikami (zależnie od dostępności danej metody w ośrodku badawczym oraz woli badacza) i używano innych wartości odcięcia dla oceny żywotności w różnych metodach obrazowania.11,12
Aktualne wytyczne European Society of Cardiology (ESC) dotyczące rewaskularyzacji mięśnia sercowego wskazują, że rewaskularyzację należy rozważyć (klasa zaleceń IIa) w przypadku żywotnego mięśnia sercowego u chorych z przewlekłą niewydolnością serca i dysfunkcją skurczową lewej komory [frakcja wyrzutowa (EF – ejection fraction) ≤35%].13 Ponadto zgodnie z rekomendacjami dotyczącymi niewydolności serca u pacjentów z podejrzeniem niewydolności serca oraz choroby wieńcowej trzeba rozpatrzyć (IIa) wykonanie jednego z badań obrazowych pozwalających na ocenę żywotności oraz odwracalnego niedokrwienia [(obciążeniowe badanie echokardiograficzne, rezonans magnetyczny serca (CMR – cardiac magnetic resonance), SPECT lub pozytonowa tomografia emisyjna (PET – positron emission tomography)], aby podjąć decyzję o rewaskularyzacji.14 Jednocześnie podkreśla się, że u chorych z przewlekłą niewydolnością serca i towarzyszącą chorobą niedokrwienną serca, bez dolegliwości dławicowych oraz w przypadku braku stwierdzonej żywotności mięśnia sercowego zabieg rewaskularyzacji jest niewskazany (III).14
Natomiast według najnowszych wytycznych ESC dotyczących stabilnej choroby niedokrwiennej serca (2013) rewaskularyzację należy rozważyć w przypadku duszności lub objawów niewydolności serca oraz zachowanej żywotności obejmującej >10% mięśnia sercowego zaopatrywanego przez naczynie zwężone >50%. Służy to złagodzeniu objawów utrzymujących się w trakcie stosowania optymalnej terapii farmakologicznej (IIa). W celu poprawy rokowania można rozpatrzyć takie postępowanie (IIb).15
W grupie pacjentów z niedokrwienną niedomykalnością zastawki mitralnej zabieg chirurgicznej wymiany zastawki połączony z CABG powinien być brany pod uwagę w przypadku ciężkiej postaci wady, upośledzonej funkcji skurczowej lewej komory (EF <30%), odpowiednich warunków anatomicznych w zakresie tętnic wieńcowych pozwalających na wykonanie rewaskularyzacji oraz w przypadku udokumentowanej zachowanej żywotności mięśnia sercowego (IIa).16
U chorych po przebytym ostrym zespole wieńcowym ocena obszaru żywotnego mięśnia sercowego oraz wielkości strefy objętej nieodwracalną martwicą ma istotną wartość prognostyczną: pozwala nie tylko przewidywać poprawę globalnej funkcji skurczowej lewej komory oraz jej przebudowę,17 lecz także precyzyjniej określić rokowanie pacjenta.18
Techniki oceny żywotności mięśnia sercowego
Oceny żywotności mięśnia sercowego można dokonywać za pomocą rozmaitych technik obrazowania, oceniających różne cechy żywotnego mięśnia sercowego. Należy jednak pamiętać, że nie wszystkie jego charakterystyczne cechy muszą występować jednocześnie. Z tego powodu mogą pojawiać się rozbieżności w wynikach poszczególnych badań obrazowych wykonanych w celu oceny żywotności.19 Przykładowo w przebiegu przewlekłego niedokrwienia dochodzi do zmian adaptacyjnych mięśnia sercowego, mogących objawiać się brakiem obserwowanej rezerwy kurczliwości przy stale zachowanych podstawowych parametrach czynnościowych kardiomiocytów w danym obszarze niedokrwienia (zachowany metabolizm glukozy, utrzymana integralność błon komórkowych miocytów).20
Echokardiografia spoczynkowa
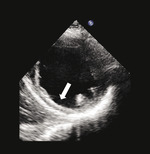
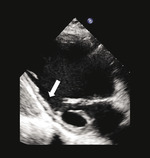
Rycina 1. Spoczynkowe przezklatkowe badanie echokardiograficzne (projekcja przymostkowa w osi krótkiej i zmodyfikowana projekcja koniuszkowa) u pacjenta po rozległym zawale ściany dolnej przebytym 5 lat wcześniej. Ściana dolna charakteryzuje się znacznym zmniejszeniem grubości końcoworozkurczowej (5 mm, strzałki), co wskazuje na obecność blizny i nieodwracalnego uszkodzenia