Niewydolność serca
Rola ultrafiltracji w leczeniu chorych z niewydolnością serca
Anna Ledakowicz-Polak,1 Ilona Kurnatowska,2 Marzenna Zielińska1
Wprowadzenie
Niewydolność serca (NS) stanowi niezwykle istotny problem zdrowotny w Polsce i na całym świecie. Rozpoznawana jest u 6-10% osób po 65 r.ż. i aż u 10-20% u osób po 70 r.ż. Chorzy z NS wymagają częstszych niż np. chorzy z dławicą piersiową konsultacji u lekarza podstawowej opieki zdrowotnej, a w przypadku dekompensacji stosunkowo długich i kosztownych pobytów na oddziałach kardiologicznych i internistycznych. Mimo pełnego leczenia farmakologicznego i wykorzystania technik zabiegowych wobec wielu chorych z NS lekarz pozostaje bezradny. Przewlekła zaawansowana niewydolność serca istotnie ogranicza codzienną aktywność życiową i obniża jakość życia, prowadząc zwykle do inwalidztwa, a następnie zgonu. W Stanach Zjednoczonych NS jest najczęstszą przyczyną hospitalizacji osób powyżej 65 r.ż. Szacuje się, że około 40% chorych hospitalizowanych z powodu niewydolności serca, zostanie ponownie przyjęta na oddział lub umrze w ciągu roku, a 50% chorych umrze w ciągu 4 lat od postawienia tego rozpoznania [1].
Duże wieloośrodkowe rejestry chorych, m.in. ADHERE, EHFS, OPTIMIZE-HF, pozwoliły określić profil pacjenta hospitalizowanego z powodu objawów niewydolności serca. Blisko 80% z nich to chorzy z wcześniej zdiagnozowaną NS, u których doszło do ostrej lub stopniowej dekompensacji krążenia. Niezależnie od rodzaju i zaawansowania dysfunkcji komór serca większość chorych (>90%) manifestuje przy przyjęciu do szpitala objawy retencji płynów wyrażone najczęściej dusznością, zastojem płucnym, poszerzeniem żył szyjnych i obrzękami obwodowymi. Nierzadko objawom tym towarzyszą przesięki do dużych jam surowiczych (otrzewnej, opłucnej). U większości chorych stwierdza się prawidłowe lub podwyższone ciśnienie tętnicze. Jedynie u 2% ciśnienie skurczowe wynosi <90 mm Hg. Chorzy prowadzący codzienne pomiary masy ciała podają, że w okresie poprzedzającym hospitalizację stwierdzili jej znaczący przyrost [1-4].
Patomechanizm retencji wody i sodu w niewydolności serca
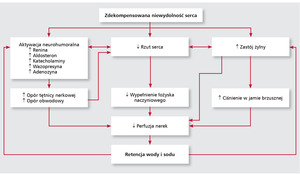
Mechanizm patofizjologiczny retencji wody i sodu w organizmie został dobrze poznany dzięki wyjaśnieniu roli odpowiedzi neurohumoralnej na zmiany hemodynamiczne zachodzące u chorych z niewydolnością krążenia (ryc. 1). Zmniejszony rzut serca powodujący spadek wypełnienia łożyska tętniczego oraz wzrost przeciążenia przedsionków prowadzi zarówno do nadmiernej stymulacji adrenergicznej, jak i aktywacji układu renina-angiotensyna-aldosteron (RAA) oraz do wzmożonego wydzielania wazopresyny i endoteliny. Zmiany te na początku służą wyrównaniu zaburzeń krążenia i we wczesnych stadiach niewydolności serca pozwalają utrzymać prawidłową perfuzję ważnych narządów i zwiększyć objętość krwi tętniczej. W miarę postępu choroby aktywacja neurohumoralna układu krążenia prowadzi do niepożądanej nadmiernej wazokonstrykcji, zwiększenia obciążenia następczego oraz nadmiernej nerkowej retencji soli i wody, a w zaawansowanej NS skutkuje powstaniem tzw. błędnych kół patofizjologicznych [5-8].
Zwiększona stymulacja współczulna prowadzi w początkowym okresie do poprawy kurczliwości mięśnia sercowego i wzrostu częstości rytmu serca, co zwiększa pojemność minutową. Następnie utrzymująca się nadmierna aktywacja adrenergiczna prowadzi do przerostu, a potem zwłóknienia i martwicy kardiomiocytów, do obniżenia gęstości i czułości receptorów β-adrenergicznych w mięśniu sercowym oraz do powstawania zaburzeń rytmu. Wzmożona stymulacja współczulna wpływa niekorzystnie na funkcję nerek przez aktywację układu RAA, wzrost cewkowej resorpcji sodu oraz wzrost nerkowego oporu naczyniowego, co skutkuje spadkiem przesączania kłębuszkowego [7,9].
Nadmierna aktywność układu RAA, manifestująca się zwiększonym stężeniem osoczowym elementów tego układu, jest odpowiedzialna za skurcz naczyń i wzrost oporu obwodowego (działanie bezpośrednie angiotensyny II) oraz zatrzymywanie wody i sodu (działanie aldosteronu). Aldosteron uważa się obecnie za niezależny element układu RAA o niekorzystnym działaniu. Oprócz zatrzymywania sodu i wody powoduje on utratę potasu i może prowadzić do włóknienia mięśnia sercowego i naczyń oraz nasilać dysfunkcję układu autonomicznego.
W mechanizmie retencji wody w niewydolności serca istotną rolę odgrywa również zwiększone uwalnianie wazopresyny (vasopressin, AVP). Hormon ten, syntetyzowany w podwzgórzu, kurczy naczynia za pośrednictwem receptorów V1 obecnych w mięśniówce naczyń krwionośnych i powoduje zatrzymanie wody przez receptory V2 zlokalizowane w dystalnych kanalikach nerkowych. AVP wywiera ponadto niekorzystny wpływ mitogenny bezpośrednio na komórki mięśnia sercowego.
Próbą przeciwdziałania niekorzystnym skutkom aktywacji neurohumoralnej jest wzmożone wydzielanie peptydów natriuretycznych: przedsionkowego (ANP) i typu B (BNP). ANP jest magazynowany głównie w prawym przedsionku, natomiast BNP w mięśniu sercowym obu komór. Bezpośrednim impulsem powodującym ich uwalnianie jest zwiększone naprężenie ścian jam serca. Białka te powodują rozszerzenie naczyń i natriurezę oraz przeciwdziałają zatrzymywaniu wody wywołanemu przez pobudzony układ adrenergiczny, RAA i AVP. Niestety, siła ich działania słabnie w miarę postępującej aktywacji adrenergicznej [5,6,9].
W codziennej opiece ambulatoryjnej nad chorymi z przewlekłą niewydolnością serca niezwykle ważną rolę w zapobieganiu retencji płynów odgrywają: ograniczenie spożycia płynów i soli oraz leczenie farmakologiczne. Postęp zasadniczej choroby serca, choroby dodatkowe i czynniki socjoekonomiczne to najczęstsze przyczyny zachwiania uzyskanej równowagi, prowadzące do istotnego przeciążenia objętościowego wymagającego hospitalizacji.
Leczenie farmakologiczne przeciążenia objętościowego w zdekompensowanej niewydolności serca
Dożylna terapia diuretykami pętlowymi jest uznana za rutynową w leczeniu przeciążenia objętościowego w zdekompensowanej niewydolności serca. Diuretyki znoszą objawy zastoju oraz zmniejszają obciążenie wstępne i następcze dzięki działaniu odwadniającemu. Leki te są stosowane powszechnie ze względu na dużą skuteczność (zwłaszcza w początkowej fazie niewydolności serca), mały koszt i łatwość podawania. Mają one jednak również działania niepożądane. Należą do nich m.in.: aktywacja kaskady neurohumoralnej (głównie układów RAA i współczulnego), dyselektrolitemia i neurotoksyczność [10-12].
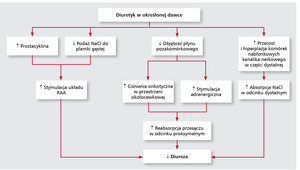
Jednak największym problemem podczas leczenia diuretykami, zwłaszcza u chorych z zaawansowaną NS, jest rozwój oporności na te leki. Za jej powstanie odpowiedzialnych jest wiele mechanizmów, m.in. tzw. zjawisko hamowania (braking phenomenon) polegające na nasileniu reabsorbcji sodu i osłabieniu efektu natriuretycznego w wyniku przerostu komórek nabłonkowych dystalnych cewek nerkowych (ryc. 2) [13].
Oporność na leczenie moczopędne rozpoznajemy, kiedy utrzymują się masywne obrzęki, mimo stosowania odpowiednich dawek diuretyku (160-240 mg furosemidu na dobę lub większych przy obniżonej filtracji kłębuszkowej), zmniejszenia aktywności fizycznej chorego, ograniczenia podaży płynów do ok. 1,5 litra na dobę i wprowadzenia ograniczeń w przyjmowaniu sodu poniżej 2,0 g na dobę. Aby ją przełamać, próbuje się różnych metod: podawania diuretyków pętlowych dożylnie we wlewie ciągłym lub ich łączenia z lekami moczopędnymi o innym punkcie działania w cewce nerkowej. Często jednak nie udaje się uzyskać efektywnej diurezy. W takich przypadkach zastosowanie ultrafiltracji w celu zmniejszenia przeciążenia objętościowego wydaje się postępowaniem z wyboru [12-14].
Mechanizm działania ultrafiltracji
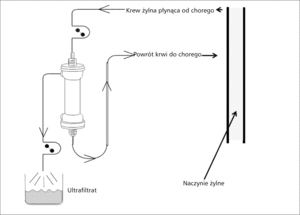
Ultrafiltracja oznacza mechaniczne usuwanie z osocza wody, a także niektórych rozpuszczonych w niej substancji, drogą transportu konwekcyjnego. Transport konwekcyjny to przepływ przez błonę półprzepuszczalną wymuszony różnicą ciśnień hydrostatycznych. Przez membranę przenika rozpuszczalnik, czyli woda i cząstki substancji o wielkości mniejszej od tzw. granicznej rozdzielczości, czyli w przypadku ultrafiltracji od 500 do 5000 daltonów. Przykładem takich cząsteczek są jony sodu i niektóre cytokiny prozapalne. Uzyskany ultrafiltrat jest izotoniczny w stosunku do osocza, tzn. zawiera elektrolity w stężeniu odpowiadającym osoczowemu. W trakcie zabiegu ultrafiltracji nie używa się płynu dializacyjnego (ryc. 3) [13,15].
Powolne usuwanie wody z osocza skutkuje niewielkim wzrostem jego ciśnienia onkotycznego. Zjawisko to inicjuje przemieszczenie płynów z obrzękniętych przestrzeni śródmiąższowych, a także z wnętrza przewodnionych komórek do łożyska naczyniowego, co klinicznie manifestuje się stopniowym ustępowaniem obrzęków. Szybkość przepływu płynów z przestrzeni śródmiąższowych i wewnątrzkomórkowych do osocza nazywana jest wskaźnikiem napełniania osoczowego (plasma refill rate, PRR). Zależy on nie tylko od ciśnienia osmotycznego, ale także od ciśnienia hydrostatycznego w kapilarach i tkance śródmiąższowej. W praktyce klinicznej należy zwracać uwagę, aby szybkość pozyskiwania ultrafiltratu nie przekraczała PRR (do jego wyliczeń służą wzory wykorzystujące wartość hematokrytu) [15,16].