Rola leków przeciwleukotrienowych w terapii zapalenia błony śluzowej nosa i zatok przynosowych
Mitchell H. Grayson, MD
Phillip E. Korenblat, MD
W SKRÓCIE
Badania nad lekami przeciwleukotrienowymi trwają od ponad 15 lat. W artykule omawiamy rolę leukotrienów w leczeniu zapalenia błony śluzowej nosa (rhinitis) oraz zapaleniu błony śluzowej nosa i zatok przynosowych (rhinosinusitis). Prezentujemy piśmiennictwo potwierdzające zasadność stosowania leków przeciwleukotrienowych w tych chorobach. Wiadomo, że leki te są skuteczne w terapii zapalenia błony śluzowej nosa, ale nie jest jasne, jaka jest ich pozycja wśród innych leków. Nie ma jednoznacznych dowodów potwierdzających ich rolę w zapaleniu zatok przynosowych z wyjątkiem chorób układu oddechowego zaostrzanych przez kwas acetylosalicylowy, przebiegających z zajęciem zatok. Wyniki badań pozwalają uznać leki przeciwleukotrienowe za skuteczne w tych chorobach. Poniżej przedstawiamy uzasadnienie dla ich stosowania w oczekiwaniu na wyniki przyszłych badań klinicznych, które pomogą wyjaśnić to ważne zagadnienie.
Wprowadzenie
Badania nad rolą leków przeciwleukotrienowych w takich zespołach chorobowych, jak astma, zapalenie błony śluzowej nosa, polipy nosa oraz choroby układu oddechowego zaostrzane przez kwas acetylosalicylowy (AERD – aspirin-exacerbated respiratory disease) prowadzone są już od ponad 15 lat. Zasady prawidłowego stosowania tych leków w chorobach nosa i zatok innych niż AERD nie są jednak dotąd w pełni ustalone. W przedstawionej pracy analizujemy znaczenie szlaku leukotrienowego w zapaleniu błony śluzowej nosa i zatok (rhinosinusitis). Dokonaliśmy również przeglądu aktualnego piśmiennictwa na temat stosowania leków przeciwleukotrienowych w wymienionych zespołach chorobowych i przedstawiliśmy przegląd ich zastosowania w zapaleniu błony śluzowej nosa i zatok przynosowych (rhinosinusitis). Liczba doniesień dotyczących tej choroby jest niestety ograniczona, mamy natomiast sporo danych na temat leczenia zapalenia błony śluzowej nosa (rhinitis). Dostępne są również dane na temat skuteczności leków przeciwleukotrienowych w zapaleniu błony śluzowej nosa i zatok w przebiegu AERD. W przyszłości konieczne będzie przeprowadzenie badań nad zespołami przebiegającymi z zajęciem błony śluzowej nosa i zatok niezwiązanymi z AERD. Mamy nadzieję, że takie badania pozwolą właściwie określić miejsce omawianych leków w terapii tych zaburzeń.
Kaskada leukotrienowa
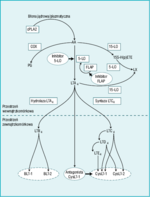
Rycina 1. Leukotrieny (LT) powstają w wyniku działania cytolozowej fosfolipazy A2 (cPLA2) na błony komórkowe w celu uwolnienia kwasu arachidonowego (AA), który następnie jest przekształcany w prostaglandyny (PG), lipoksyny (LX) lub leukotrien A4 (LTA4), albo uwalniany z komórki i przekształcany w LTB4 lub LTC4. W przestrzeni pozakomórkowej LTC4 jest bardzo szybko hydrolizowany do LTD4, a następnie do LTE4; te trzy leukotrieny nazywane są wspólnie leukotrienami cysteinylowymi (CysLT). Istnieją dwa receptory wiążące LTB4: receptor 1 (BLT-1) na limfocytach T i neutrofilach i receptor 2 (LTB-2) na neutrofilach. Analogicznie receptory CysLT-1 (na powierzchni komórek mięśni gładkich i eozynofili) i CysLT-2 (na powierzchni gruczołów śluzowych) są zdolne do wiązania leukotrienów cysteinylowych (LTE4 może wiązać się wyłącznie z CysLT-1)
Kwas arachidonowy stanowi integralną składową podwójnej warstwy lipidowej błon komórkowych i jądrowych. Enzym o nazwie cytozolowa fosfolipaza A2 (cPLA2) bierze udział w powstawaniu wolnej formy kwasu arachidonowego, uwalniając go z warstwy lipidowej błon biologicznych.1 Wolny kwas arachidonowy może zostać wykorzystany jako substrat do produkcji prostaglandyn, leukotrienów lub lipoksyn (ryc. 1). Prostaglandyny powstają po zadziałaniu enzymu cyklooksygenazy (COX) na kwas arachidonowy. Enzym COX występuje w dwóch formach – jedna jest formą konstytutywną (COX-1), druga – indukowana – powstaje w miejscu stanu zapalnego (COX-2).2

Tabela 1. Wpływ przewlekłego zapalenia błony śluzowej nosa i zatok przynosowych oraz polipów nosa na aktywność enzymów lipidowych, stężenie mediatorów i receptorów
Drugi szlak przemian kwasu arachidonowego katalizowany jest przez enzym 15-lipooksygenazę (15-LO). Powstaje w nim pośredni związek lipidowy – 15S-H(p)ETE, czyli kwas hydro(pero)heikozatetraenowy, a ostatecznie wytwarzane są przeciwzapalne lipoksyny (LX) A4 i B4.3 Nie wiemy, jakie jest znaczenie LXA4 i LXB4 w zapaleniu błony śluzowej nosa, ale przypuszcza się, że mogą one odgrywać pewną rolę przeciwzapalną, neutralizując reakcję zapalną indukowaną przez leukotrieny. Innym enzymem koniecznym do powstania lipoksyn jest 5-lipooksygenaza (5-LO), która działa na końcowym etapie przemian kwasu arachidonowego. W obecności enzymu koaktywującego (białka aktywującego 5-LO zwanego FLAP), 5-LO przekształca wolny kwas arachidonowy w leukotrien A4 (LTA4).
Dalsze przemiany leukotrienu A4 mogą przebiegać w czterech kierunkach. Może on być wydalany z komórki w formie niezmienionej i wychwytywany przez sąsiadujące komórki, a następnie przetwarzany w inne leukotrieny, zależnie od zawartości enzymów w komórce. Pod wpływem 15-LO powstają z niego lipoksyny. Pod wpływem enzymu o nazwie hydrolaza LTA4 leukotrien A4 przekształcany jest w leukotrien B4 (LTB4), który transportowany jest następnie specjalnym kanałem poza komórkę i odgrywa znaczącą rolę w zapaleniu w przebiegu zakażeń, działając chemotaktycznie w stosunku do limfocytów T i neutrofili. Leukotrien B4 działa za pośrednictwem dwóch znanych receptorów leukotrienowych – 1 i 2 (BLT-1 i BLT-2), przekazujących sygnały przez białko G.4,5 Ekspresja BLT-1 jest ograniczona do leukocytów, natomiast BLT-2 znajduje się w wielu tkankach (jeśli nie w większości). Wiadomo, że istnieją antagoniści receptorów LTB4, ale nie wprowadzono do lecznictwa substancji o takim mechanizmie działania. Obecnie jedynie inhibitor enzymu 5-LO może wpływać na stężenie LTB4.
Leukotrien B4 może odgrywać ważną rolę w astmie ciężkiej, powodując przyciąganie limfocytów pamięci i efektorowych CD4 oraz CD8.6-9 Nie jest pewne czy podobny mechanizm odgrywa rolę w zapaleniu błony śluzowej nosa lub rhinosinusitis, ale jest to bardzo prawdopodobne. LTA4 może być też przekształcony w LTC4 pod wpływem działania enzymu cytozolowego syntazy LTC4 lub mikrosomalnych transferaz glutationowych II lub III. LTC4 jest jednym z trzech leukotrienów cysteinylowych, nazwanych tak z powodu zawartej w nich cysteiny, której nie posiada LTA4 ani LTB4.10 Swoiste białko kanałowe MRP-1 (the multidrug resistance-associated protein 1) transportuje LTC4 na zewnątrz komórki w sposób podobny jak LTB4.11 W środowisku pozakomórkowym LTC4 jest szybko katabolizowany do innych leukotrienów cysteinylowych, najpierw do LTD4, który ulega szybkiej konwersji do LTE4.
Do komórek, które mogą wytwarzać LTC4 bezpośrednio z kwasu arachidonowego, należą komórki tuczne, monocyty, granulocyty kwasochłonne i zasadochłonne.12 Komórki śródbłonka i płytki krwi nie zawierają 5-LO i nie mogą wytwarzać LTA4, ale – jak wspomniano wcześniej – LTA4 uwalniany przez inne komórki do przestrzeni pozakomórkowej może być pobierany przez komórki śródbłonka i płytki, a następnie przekształcany w LTC4.1,13,14
LTC4 jest związkiem stosunkowo niestabilnym, który szybko przekształcany jest w LTD4 i LTE4, natomiast LDE4 jest produktem stabilnym, wydalanym przez nerki. W rezultacie stężenie LTE4 w moczu koreluje w przybliżeniu z całkowitą zawartością leukotrienów cysteinylowych w organizmie.15
Leukotrieny cysteinylowe mogą wiązać się z co najmniej dwoma znanymi receptorami, które podobnie jak BLT-1 i BLT-2 są związane z białkiem G. Receptor CysLT-1, odkryty jako pierwszy, ma zdolność wiązania wszystkich leukotrienów cysteinylowych i znajduje się na eozynofilach, monocytach, komórkach mięśni gładkich dróg oddechowych, neutrofilach, limfocytach B, komórkach plazmatycznych oraz makrofagach tkankowych.16-18 Drugi receptor, CysLT-2, charakteryzuje się większym powinowactwem do LTC4 i LTD4 w porównaniu z LTE4 i znajduje się w wielu tkankach organizmu, m.in. w nabłonku błony śluzowej nosa, gruczołach śluzowych i leukocytach w jamie nosa (choć w małej ilości), co sugeruje, że może on odgrywać istotną rolę w zapaleniu błony śluzowej nosa oraz rhinosinusitis. Nie wyjaśniono dotąd, w jaki dokładnie sposób CysLT-2 moduluje odpowiedź immunologiczną, wiadomo jednak, że główne działanie leukotrienów na gruczoły śluzowe może odbywać się za pośrednictwem sygnałów z receptorów CysLT-2.19,20
Leukotrieny w zapaleniu błony śluzowej nosa oraz zapaleniu błony śluzowej nosa i zatok przynosowych
W tkankach nosa i zatok przynosowych u chorych na przewlekłe zapalenie błony śluzowej nosa i zatok lub z polipami nosa obserwuje się zwiększoną ekspresję wielu enzymów i substancji lipidowych należących do szlaku leukotrienowego, co pokazano w tabeli 1. W tkankach tych stwierdza się ponadto zwiększoną gęstość receptorów dla tych substancji, która najczęściej koreluje z liczbą eozynofili. Dane te sugerują, że leukotrieny mogą odgrywać istotną rolę w rekrutacji i gromadzeniu tych komórek zapalnych w błonie śluzowej nosa i zatok przynosowych. Co więcej, w granulocytach kwasochłonnych obecna jest syntaza LTC4, dzięki czemu prawdopodobnie komórki te przyczyniają się do podtrzymywania rekacji zapalnej zapoczątkowanej przez leukotrieny cysteinylowe. Niedawno opublikowano szczegółowy artykuł przeglądowy na temat możliwej roli leukotrienów w zapaleniu błony śluzowej nosa.21
Biorąc pod uwagę, że wymienione mediatory są obecne w błonie śluzowej nosa, a ich stężenie zwiększa się w stanach chorobowych, należy przypuszczać, że odgrywają one znaczącą rolę w patofizjologii zapalenia błony śluzowej nosa i zatok przynosowych. Wprowadzenie na początku lat 90. ubiegłego wieku leków przeciwleukotrienowych w leczeniu alergicznego nieżytu nosa przyniosło jednak rozbieżne wyniki. Inhibitor 5-LO – zyleuton – zmniejszał objawy, podczas gdy antagoniści receptorów CysLT-1 nie wykazywały takiego działania. Te pierwsze badania obejmowały stosunkowo małe grupy pacjentów, a największe z nich (164 pacjentów) potwierdziło poprawę w zakresie objawów ze strony nosa w próbie prowokacyjnej z alergenem po zastosowaniu pojedynczej dawki zafirlukastu. W ostatnich sześciu latach przeprowadzono ponad 30 badań klinicznych oceniających zastosowanie antagonistów receptorów CysLT-1 (głównie montelukastu) w leczeniu zapalenia błony śluzowej nosa. Niektóre z nich porównywały lek przeciwleukotrienowy z placebo, inne oceniały jego połączenia z lekami przeciwhistaminowymi, a jeszcze inne porównywały wymienione leki z kortykosteroidami donosowymi. Mimo różnorodności protokołów, na podstawie przeglądu tych badań możliwe było opracowanie pewnych wytycznych dotyczących stosowania leków przeciwleukotrienowych w zapaleniu błony śluzowej nosa. Prawie wszystkie z przeprowadzonych dotychczas badań wskazują na korzystny wpływ leków przeciwleukotrienowych w leczeniu sezonowego i całorocznego alergicznego zapalenia błony śluzowej nosa.22,23 Leki te wydają się być też skuteczne w terapii polipów nosa. Jednak ze względu na dostępność również innych leków (kortykosteroidy donosowe, leki zmniejszające przekrwienie błony śluzowej nosa, leki przeciwhistaminowe) pomocnych w leczeniu wymienionych stanów chorobowych pojawia się pytanie, jakie jest miejsce leków przeciwleukotrienowych w terapii tych chorób. Na podstawie dostępnych danych bardzo trudno jest odpowiedzieć na to pytanie. W 2003 r. opublikowaliśmy przegląd piśmiennictwa, w którym sformułowaliśmy wniosek, że „dane nie potwierdzają zasadności szerokiego zastosowania leków przeciwleukotrienowych w połączeniu z lekiem przeciwhistaminowym lub bez niego zamiast donosowego kortykosteroidu z lekiem przeciwhistaminowym lub bez niego”.24 Taka konkluzja była spowodowana częściowo tym, że było bardzo mało badań porównujących różne schematy leczenia, a w większości z nich uczestniczyły małe grupy badanych (doniesienia podsumowane we wspomnianym artykule przedstawione w pozycjach piśmiennictwa 25-41). Od czasu opublikowania tamtej analizy przeprowadzono co najmniej kilka badań porównujących różne strategie lecznicze; omówione poniżej.
Leki przeciwhistaminowe a leki przeciwleukotrienowe
Skuteczność leków przeciwhistaminowych i przeciwleukotrienowych porównywano w dwóch badaniach. W większym z nich, w którym uczestniczyło 60 dzieci (w wieku 2-6 lat) z całorocznym alergicznym zapaleniem błony śłuzowej nosa, cetyryzyna skuteczniej niż montelukast zmniejszała nasilenie objawów ocenianych w skali punktowej, przy czym oba leki były skuteczniejsze niż placebo.42 Warto jednak zwrócić uwagę, że wyjściowo grupa leczona cetyryzyną miała wyższą punktację w skali oceny objawów, co pozwoliło uzyskać wyraźniejszą poprawę niż w grupie leczonej montelukastem. Drugie badanie oceniało skuteczność leczenia feksofenadyną, montelukastem, placebo lub feksofenadyną w połączeniu z montelukastem u 12 osób z całorocznym alergicznym zapaleniem błony śłuzowej nosa.43 W badaniu tym porównywano między sobą wszystkie rodzaje terapii pod względem zmniejszania objawów ze strony nosa oraz zmniejszenia indukowanego monofosforanem adenozyny spadku maksymalnego wdechowego przepływu nosowego (we wszystkich uzyskano lepsze wyniki niż w grupie placebo).