Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Program edukacyjny: diabetologia
Rola aldosteronu w rozwoju chorób układu krążenia u chorych na cukrzycę i nadciśnienie tętnicze: najnowsze dane
Guido Lastra-Gonzalez, MD
Camila Manrique-Acevedo, MD
James R. Sowers, MD
W SKRÓCIE
Rola mineralokortykosteroidów w rozwoju chorób układu krążenia, zespołu kardiometabolicznego, cukrzycy typu 2, przewlekłej choroby nerek i nadciśnienia tętniczego budzi coraz większe zainteresowanie. Odkryto, że aldosteron wpływa na rozwój chorób układu krążenia i przewlekłej choroby nerek, działając głównie w mechanizmach pozagenowych, powodując rozrost, włóknienie, rozwój zapalenia i przebudowę narządową. Zwiększone stężenie aldosteronu towarzyszy oporności na działanie insuliny i upośledzeniu gospodarki węglowodanowej, które przyczyniają się do rozwoju dysfunkcji śródbłonka, miażdżycy i przewlekłej choroby nerek. Kluczową rolę w zaburzaniu przekaźnictwa sygnałów komórkowych uruchamianych pod wpływem insuliny odgrywają stres oksydacyjny i reakcja zapalna, wywoływane działaniem aldosteronu. Blokada receptorów mineralokortykosteroidowych przywraca wrażliwość tkanek na insulinę, stanowi przeciwwagę dla szkodliwego działania aldosteronu na układ krążenia i nerki oraz wydaje się alternatywą, która pozwoli zwiększyć blokadę układu renina-angiotensyna-aldosteron. Może to przyczynić się do zmniejszenia zachorowalności na choroby układu krążenia i przewlekłą chorobę nerek oraz liczby powodowanych przez nie zgonów.
Wprowadzenie
Choroby układu krążenia są na świecie główną przyczyną zachorowań i zgonów. Wiadomo, jaką rolę odgrywają w ich rozwoju klasyczne czynniki ryzyka. W zespole kardiometabolicznym obserwuje się nagromadzenie tych czynników: otyłość brzuszna współwystępuje z zaburzeniami gospodarki węglowodanowej, aterogenną dyslipidemią i nadciśnieniem tętniczym. Zwiększa to w istotny sposób ryzyko chorób układu krążenia i przewlekłej choroby nerek. Najważniejsze zaburzenia w patofizjologii zespołu kardiometabolicznego i cukrzycy typu 2 – dwóch stanów szczególnie zagrażających rozwojem chorób układu krążenia – to rozwój oporności na działanie insuliny i zniszczenie komórek β. Oporność na insulinę ma bezpośredni wpływ na rozwój zaburzeń naczyniowych i miażdżycy, tym samym zwiększa ryzyko chorób układu krążenia oraz przewlekłej choroby nerek.
Interesującym polem do badań są zarówno mechanizmy rozwoju oporności na działanie insuliny, jak i relacja między insulinoopornością, nadciśnieniem tętniczym, chorobami układu krążenia i przewlekłą chorobą nerek. Wydaje się, że procesy patofizjologiczne leżące u podłoża tych zaburzeń w dużym stopniu wiążą się z otyłością, jedną z najszybciej szerzących się epidemii naszych czasów. Badania epidemiologiczne wykazały, że nadwaga i otyłość, na które cierpi 2/3 amerykańskiej populacji, są główną przyczyną dramatycznego wzrostu częstości występowania u dorosłych zespołu kardiometabolicznego i cukrzycy typu 2. Według danych z badania Third National Health and Nutrition Examination Survey (NHANES III) częstość występowania zespołu kardiometabolicznego w USA może przekraczać 34%.1 Wyniki tego samego badania wskazują też, że zespół kardiometaboliczny, otyłość i nadwaga coraz częściej występują również u dzieci i nastolatków.2 Zwiększone ryzyko rozwoju zespołu kardiometabolicznego obserwuje się także wśród mniejszości etnicznych, zwłaszcza Latynosów i Afroamerykanów.
Dobrze znany jest związek między insulinoopornością a nadciśnieniem tętniczym, kolejnym istotnym czynnikiem ryzyka rozwoju chorób układu krążenia i przewlekłej choroby nerek. W Stanach Zjednoczonych na nadciśnienie tętnicze choruje blisko 70 mln osób. U ponad połowy z nich stwierdza się insulinooporność, upośledzoną tolerancję glukozy lub oba te stany. W populacji chorych na cukrzycę z opornym na leczenie nadciśnieniem tętniczym nierzadko stwierdza się pierwotny hiperaldosteronizm – może występować w 14% przypadków.3 Wskazuje to, że osoby chore na cukrzycę, u których nie udaje się kontrolować nadciśnienia tętniczego, powinno się badać w kierunku pierwotnego hiperaldosteronizmu.
U pacjentów z nadciśnieniem tętniczym obserwuje się wyższe stężenia insuliny na czczo i po posiłku oraz cechy oporności na insulinę niezależnie od wskaźnika masy ciała (BMI – body mass index) i rozkładu tkanki tłuszczowej w organizmie.4 Co więcej, zarówno insulinooporność, jak i nadciśnienie tętnicze biorą udział w patofizjologii miażdżycy, która zwiększa ryzyko chorób układu krążenia; na podstawie badań dowiedziono, że poprawa wrażliwości tkanek na insulinę korzystnie wpływa na kontrolę ciśnienia tętniczego.5
Prawdopodobnie za związek między nadciśnieniem tętniczym a cukrzycą odpowiadają liczne czynniki, w tym nieprawidłowa aktywacja układu renina-angiotensyna-aldosteron, stres oksydacyjny i przewlekłe zapalenie naczyń o niewielkim nasileniu.5 W artykule przedstawiono aktualny stan wiedzy na temat znaczenia mineralokortykosteroidów, będących elementem układu renina-angiotensyna-aldosteron, w rozwoju chorób układu krążenia u osób z nadciśnieniem tętniczym, cukrzycą typu 2 i zespołem kardiometabolicznym.
Nadmierna aktywacja układu renina-angiotensyna-aldosteron i aktywność mineralokortykosteroidowa
Cechy nadmiernej aktywacji układu renina-angiotensyna-aldosteron (ogólnoustrojowego i układów tkankowych) można zaobserwować u osób z zespołem kardiometabolicznym albo niektórymi jego elementami, np. otyłością, cukrzycą typu 2, przewlekłą chorobą nerek lub nadciśnieniem tętniczym. Coraz większe zainteresowanie budzi lokalny układ renina-angiotensyna-aldosteron w tkance tłuszczowej, jego związek z adipokinami zwłaszcza w otyłości brzusznej i zespole kardiometabolicznym.6 Wydaje się, że układ renina-angiotensyna-aldosteron wpływa na rozwój zespołu kardiometabolicznego przez zwiększenie wytwarzania angiotensyny II z aktywacją receptora typu 1 dla angiotensyny II (AT1R) oraz zwiększone wytwarzanie aldosteronu.7 To z kolei prowadzi do wzrostu wytwarzania reaktywnych rodników tlenowych w wyniku aktywacji kompleksu enzymatycznego oksydazy NADPH w różnych tkankach (m.in. w mięśniach szkieletowych, które są klasycznym przykładem tkanki wrażliwej na działanie insuliny).5,8 Nadmierne wytwarzanie rodników tlenowych powoduje zaburzenia przekaźnictwa sygnałów wewnątrzkomórkowych szlaków insulinowych i w ten sposób aktywacja układu renina-angiotensyna-aldosteron przyczynia się do rozwoju insulinooporności.9 Mechanizmy wiążące stres oksydacyjny z insulinoopornością znane są tylko częściowo i obejmują m.in. aktywację szlaków sygnalizacyjnych stresu i zapalenia, w tym czynnik jądrowy κβ, JNK/SAPK, kinazę białkową p38 aktywowaną mitogenami, kinazę Rho i szlak heksozaminowy.5,10
Angiotensyna II stymuluje warstwę kłębkowatą kory nadnerczy, co powoduje zwiększenie wydzielania mineralokortykoidów. Aldosteron stymuluje reabsorpcję sodu, co stanowi mechanizm regulacji ciśnienia tętniczego i perfuzji w warunkach niedoboru sodu albo nasilonego wydalania potasu z komórek. Nadmierne wydzielanie i zwiększona aktywność aldosteronu wywołują nadciśnienie tętnicze oraz zaburzenia gospodarki sodowo-potasowej. Co więcej, nadmiar aldosteronu doprowadza do niedoboru potasu i pośrednio także magnezu, co również może przyczyniać się do rozwoju insulinooporności.5
Aldosteron wpływa na regulację ciśnienia tętniczego, zawartości wody i sodu oraz gospodarkę potasową za pośrednictwem receptora cytoplazmatycznego dla mineralokortykosteroidów, który jest receptorem dla steroidów i znajduje się w komórkach nabłonka. Po aktywacji receptor ten przemieszcza się do jądra komórkowego i powoduje zmiany ekspresji genów. Receptor dla mineralokortykosteroidów i receptor dla glikokortykosteroidów wykazują spory stopień homologii sekwencji przyłączających ligand oraz sekwencji przyłączających się do DNA (odpowiednio 57% i 94%). Dlatego receptor dla mineralokortykosteroidów z równie dużym powinowactwem wiąże się zarówno z mineralokortykosteroidami, jak i glikokortykosteroidami. Biorąc pod uwagę, że stężenia glikokortykosteroidów są 100-1000 razy większe niż stężenie aldosteronu, można przypuszczać, że istnieją inne mechanizmy zapewniające swoistość działania aldosteronu.11
Po części swoistość tę umożliwia związanie glikokortykosteroidów z białkami osocza, ale przede wszystkim aktywność 11-β dehydrogenazy hydroksysteroidowej typu 2, która występuje w miejscach działania mineralokortykoidów (z wyjątkiem serca i tkanki nerwowej) i która odpowiada za enzymatyczną inaktywację glikokortykosteroidów.11 Glikokortykosteroidy mogą więc działać niekorzystnie na tkankę naczyń i serca za pośrednictwem receptorów dla mineralokortykosteroidów.5
Oprócz oddziaływania na poziomie genowym aldosteron poprzez inne mechanizmy wpływa na tkanki inne niż nabłonkowa.12 Wydaje się, że mechanizmy te działają w nerkach, w sercu i w naczyniach. Nie są zależne od zmian ciśnienia zachodzących pod wpływem aldosteronu i doprowadzają do przerostu, dysfunkcji śródbłonka, zapalenia, włóknienia i przebudowy układu krążenia.5,6,13
W badaniach wykryto, że aldosteron wywołuje zaburzenia wiązania się insuliny z jej receptorem, a in vitro zmniejsza również ekspresję mRNA kodującego sekwencję aminokwasową tego receptora i o połowę redukuje ekspresję receptora dla mineralokortykosteroidów. Powiązano to z zahamowaniem zależnego od insuliny transportu glukozy i syntezy insuliny w ludzkich komórkach promonocytowych poddanych działaniu aldosteronu. O wiodącej roli receptora dla mineralokortykosteroidów świadczy też odwracalność tych zmian pod wpływem spironolaktonu.14 Aldosteron ma także udział w upośledzaniu wydzielania insuliny i przekaźnictwa wewnątrzkomórkowego.15 Wyniki nowego badania sugerują, że mineralokortykoidy wpływają na procesy biologiczne zachodzące w adipocytach tkanki tłuszczowej żółtej. Caprio i wsp.16 wykazali w badaniu na hodowlach komórkowych linii 3T3-L1 i 3T3-F442A, że aldosteron ułatwia rozwój w kierunku fenotypu adipocytów i że działanie to zależy od dawki oraz czasu, a także wiąże się z indukcją mRNA dla receptora aktywowanego proliferatorami peroksysomów typu γ. Spironolakton odwracał te zmiany, podobny skutek miało zmniejszenie ekspresji receptora dla mineralokortykosteroidów za pomocą niewielkiego interferującego RNA. Wskazuje to, że aktywacja receptora dla mineralokortykosteroidów odgrywa kluczową rolę w różnicowaniu tkanki tłuszczowej, co może mieć znaczenie dla insulinooporności.16
Aldosteron a stres oksydacyjny i insulinooporność
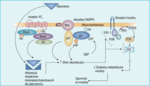
Rycina 1. Postulowane mechanizmy rozwoju insulinooporności pod wpływem aldosteronu obejmują aktywację układu renina-angiotensyna-aldosteron, prowadzącą do aktywacji receptorów AT1 dla angiotensyny II, co odpowiada za aktywację kompleksu oksydazy NADPH. To z kolei nasila wytwarzanie wolnych rodników tlenowych, które hamują ekspresję receptora dla insuliny i zmniejszają jego powinowactwo, a także nasilają fosforylację seryny w substracie receptora insulinowego IRS-1 i jego degradację proteasomalną. Zaburza to aktywność Akt i prowadzi do zaburzeń sygnalizacji wewnątrzkomórkowej, wywołującej oporność na najważniejsze działania metaboliczne insuliny
Niedawno odkryto, że aldosteron powoduje silny stres oksydacyjny i w ten sposób może wpływać na insulinooporność w komórkach naczyń (ryc. 1).6 W patogenezie powikłań zespołu kardiometabolicznego i cukrzycy typu 2 o charakterze mikro- i makroangiopatii (choroby układu krążenia, retinopatia, nefropatia, neuropatia) prawdopodobnie bierze udział dysfunkcja naczyń spowodowana wspólnym niekorzystnym działaniem hiperglikemii i oporności na insulinę/hiperinsulinemii.4
W badaniach eksperymentalnych wykazano, że przewlekły nadmiar angiotensyny i aldosteronu powoduje nasilenie fosforylacji seryny w substracie receptora insulinowego IRS-1 (insulin receptor substrate 1) w hodowli komórek mięśni gładkich naczyń. Wydaje się, że pośredniczy w tym c-Src (kinaza tyrozynowa uczestnicząca w tworzeniu wolnych rodników na drodze aktywacji oksydazy NADPH) oraz PDK1. Prowadzi to do zależnej od działania wolnych rodników fosforylacji seryny IRS-1, a następnie do degradacji proteasomalnej tego białka. To z kolei powoduje przerwanie szlaku sygnałowego Akt, który jest ważnym elementem na drodze metabolicznego działania insuliny.17 Zwiększone wytwarzanie aldosteronu w wyniku aktywacji angiotensyny II i receptora AT1 ma także mieć znaczenie dla rozwoju insulinooporności na drodze uruchomienia mechanizmów zwiększających stres oksydacyjny (c-Src i oksydaza NADPH).18
Hitomi i wsp.19 przeprowadzili badanie na hodowlach komórkowych mięśni gładkich ścian naczyń i stwierdzili, że aldosteron w sposób zależny od dawki prowadził do szybkiego spadku stężenia IRS-1 i nasilenia degradacji tego białka w proteasomach. Aldosteron niwelował też stymulowaną insuliną fosforylację Akt i upośledzał stymulowany przez insulinę wychwyt glukozy. Wybiórcza blokada receptorów dla mineralokortykosteroidów za pomocą eplerenonu, podobnie jak zastosowanie antyoskydantów, istotnie ograniczyła degradację IRS-1 i usprawniła transport glukozy zależny od insuliny. Co więcej, inhibitor Src także hamował degradację IRS-1 stymulowaną aldosteronem.19 Dane te są zgodne z aktualną wiedzą na temat kluczowej roli aldosteronu w powstawaniu stresu oksydacyjnego, który rozwija się wraz z upośledzeniem insulinowrażliwości komórek ściany naczyniowej i może wpływać na rozwój miażdżycy oraz ryzyko sercowo-naczyniowe.