Diagnostyka udaru kardiogennego
dr n. med. Jacek Staszewski1
prof. dr hab. n. med. Piotr Pruszczyk2
Udar kardiogenny (UK) jest spowodowany przez materiał zatorowy powstały na skutek zaburzeń przepływu krwi w jamach i na zastawkach serca. Należy do najważniejszych przyczyn udarów niedokrwiennych (UN) mózgu.
Wprowadzenie
W populacji ogólnej udar kardiogenny odpowiada za 25-30% wszystkich udarów niedokrwiennych, w tym za ok. połowę udarów wśród osób <45 i >80 r.ż. Szacuje się, że kolejne 30-40% UN stanowią udary kryptogenne o nieustalonej w trakcie hospitalizacji przyczynie. Za większość tych incydentów odpowiada prawdopodobnie zatorowość kardiogenna w przebiegu asymptomatycznych arytmii lub nierozpoznanych wad serca. Udar kardiogenny charakteryzuje się dużą częstością nawrotów (1% dziennie w ciągu 14 dni i ok. 10-20% w pierwszym roku od zachorowania), cięższym przebiegiem i wyższą śmiertelnością (12% przez 30 dni i 50% w okresie 3 lat) w porównaniu z UN o etiologii miażdżycowej.1,2 Wczesne wykrycie przyczyny udaru jest bardzo istotne, ponieważ umożliwia włączenie skutecznego leczenia w prewencji wtórnej. Nowe doustne leki przeciwzakrzepowe: bezpośredni inhibitor trombiny dabigatran, bezpośredni inhibitor czynnika Xa rywaroksaban i apiksaban są co najmniej tak skuteczne lub skuteczniejsze w redukcji ryzyka zatorowości w migotaniu przedsionków (MP) jak warfaryna. Antagoniści witaminy K oraz apikasaban znacznie redukują ryzyko UK w porównaniu z kwasem acetylosalicylowym (odpowiednio o 40% i 55%).3,4 Nie porównano dotychczas skuteczności innych doustnych leków przeciwzakrzepowych z lekami przeciwpłytkowymi w profilaktyce UK. Wprowadzenie nowych metod diagnostycznych – echokardiografii przezprzełykowej (TEE), przedłużonego monitorowania EKG – ułatwiło lepszą charakterystykę przyczyn zatorowości sercowopochodnej i zdefiniowanie nowych czynników ryzyka UK.5
Przyczyny udaru kardiogennego
Mechanizm prowadzący do powstawania zatorów kardiogennych zależy od obecności:
- uszkodzenia serca sprzyjającego powstaniu skrzepliny wewnątrzsercowej (np. u chorego z dużym uszkodzeniem czynności skurczowej lewej komory i wytworzeniem skrzepliny w jej koniuszku)
- skrzepliny w uszku lewego przedsionka w przebiegu MP
- masy wewnątrzsercowej o potencjalnym ryzyku embolizacji (np. guz, wegetacja zastawkowa)
- protezy zastawkowej (zwłaszcza mechaniczna zastawka w pozycji mitralnej)
- połączenia wewnątrzsercowego sprzyjającego zatorowości paradoksalnej, np. przetrwałego otworu owalnego (PFO – patent foramen ovale).
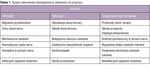
Ryzyko zatorowości obwodowej zwiększa się przy współistnieniu chorób serca (np. MP z wadą zastawkową lub niewydolnością serca) oraz czynników ryzyka miażdżycy. Najwyższe ryzyko zatorowości kardiogennej występuje u chorych z mechaniczną zastawką serca, zastawkowym MP i skrzepliną w jamach serca, u których mimo stosowania leczenia przeciwkrzepliwego (niezależnie od przyczyny) roczne ryzyko zatorowości przekracza 2% (tab. 1). W populacji ogólnej i w podeszłym wieku najczęstszą przyczyną UK jest MP, a u osób <45 r.ż. zatorowość paradoksalna w przebiegu PFO.
Mechanizm powstawania skrzeplin wewnątrzsercowych jest złożony. W przypadku MP lub zawału serca jest zapoczątkowany zastojem krwi i dysfunkcją mechaniczną poszczególnych jam serca (uszka i lewego przedsionka lub lewej komory serca). Do zatorowości przy wadach zastawkowych dochodzi przy uszkodzonym endotelium, do którego przywiera bogatopłytkowy lub zakażony materiał zatorowy. Charakter materiału zatorowego zależy od jego źródła – od uwapnionych zatorów powstających na skalcyfikowanych zastawkach do zatorów komórkami nowotworowymi przy śluzaku przedsionka.
Badania diagnostyczne w udarach kardiogennych
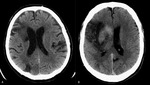
Rycina 1. TK głowy chorego z udarem kardiogennym: A – liczne wieloczasowe (głównie korowe) ogniska niedokrwienne w różnych obszarach unaczynienia; B – wtórne ukrwotocznienie rozległego korowo-podkorowego ogniska niedokrwiennego prawej okolicy skroniowo-ciemieniowej
Objawy kliniczne UN spowodowanego zatorowością sercowopochodną nie różnią się znacząco od udarów o innej etiologii. U chorych w podeszłym wieku tło kardiogenne może sugerować nagły początek zachorowania niepoprzedzony incydentem TIA oraz znaczny deficyt neurologiczny (≥10 p. w skali NIHSS) wskazujący na niedrożność dużego naczynia wewnątrzczaszkowego. U ok. 25% pacjentów obserwuje się jednak gwałtowną poprawę stanu neurologicznego (spectacular shrinking deficit) spowodowaną samoistną rezolucją bogatowłóknikowej sercopochodnej skrzepliny i reperfuzją naczynia.6 W badaniach neuroobrazowych (TK lub MR mózgu) znamienne dla UK jest rozsianie ognisk niedokrwiennych w czasie i przestrzeni z zajęciem różnych obszarów naczyniowych mózgu. Typowe są również rozległe płatowe ogniska zawałowe lub zmiany ogniskowe o klinowatym kształcie, średnicy >2 cm i lokalizacji korowej oraz wczesne, wtórne ukrwotocznienie ognisk niedokrwiennych, do którego dochodzi u ok. 70% pacjentów (ryc. 1). Prawdopodobieństwo rozpoznania napadowego MP (NMP) u chorego z udarem o niejasnej etiologii zwiększa się, gdy w badaniu obrazowym widoczne są mnogie zmiany naczyniowe mózgu (iloraz szans OR 1,7) lub ognisko niedokrwienne obejmujące korę mózgu lub móżdżek (OR 5,8). Taką przyczynę udaru należy również rozważyć u pacjentów w podeszłym wieku, z współistniejącą chorobą wieńcową oraz udarem nawrotowym mimo stosowania kwasu acetylosalicylowego. Pod-stawą w rozpoznaniu udaru kardiogennego jest ustalenie co najmniej prawdopodobnego źródła zatorowości kardiogennej oraz wykluczenie innych przyczyn udaru, w tym istotnych zmian miażdżycowych tętnic zewnątrz- i wewnątrzczaszkowych.
Diagnostyka kardiologiczna
Diagnostyka zaburzeń rytmu serca
Migotanie przedsionków jest najsilniejszym, pojedynczym, niezależnym od wieku czynnikiem ryzyka udaru oraz przyczyną 15-20 tys. UN w Polsce rocznie. Obecnie na MP choruje ok. 400 tys. Polaków. Przypuszczalnie za 20 lat liczba ta wzrośnie do 1,6 mln. W porównaniu z osobami bez arytmii z podobnymi obciążeniami naczyniowymi MP 5-krotnie zwiększa ryzyko udaru. W przypadku, gdy związane jest ono z wadą mitralną, ryzyko zatorowości rośnie 16-krotnie i wynosi 20% rocznie. Ryzyko zatorowości w niezastawkowym utrwalonym i napadowym MP jest podobne i zależy od współwystępowania innych naczyniowych czynników ryzyka. Zastoinowa niewydolność serca, nadciśnienie tętnicze, wiek >75 lat, cukrzyca, przebyty udar mózgu lub TIA zwiększają roczne ryzyko udaru w przebiegu MP u osób nieleczonych przeciwzakrzepowo od 1,8 do 18%.7 Powyżej 80% wszystkich chorych z MP ma wysokie >2% roczne ryzyko udaru.

Tabela 2. Kliniczna skala oceny ryzyka napadowego migotania przedsionków u chorych z udarem kryptogennym
Gdy u pacjenta z udarem podczas rutynowej diagnostyki stwierdza się nieleczone wcześniej NMP lub częściej MP o nieustalonym czasie trwania, zwykle to ono (a nie inne czynniki, np. nieistotne hemodynamicznie zwężenie tętnic szyjnych lub nadciśnienie tętnicze) odpowiada za udar. Trudno ustalić właściwą etiologię udaru u chorych z nierozpoznanym NMP. Wykrywalność tej postaci arytmii u pacjentów hospitalizowanych z powodu UN na podstawie samego tylko badania EKG jest niska i wynosi 2-4%.8 Dlatego bardzo ważną rolę w diagnostyce odgrywa monitorowanie EKG: badanie holterowskie w trakcie hospitalizacji przez 24 h oraz powtarzalne ambulatoryjnie 7-14-dniowe. Umożliwiają one rozpoznanie NMP u 3-10% (a nawet u 14-23%) pacjentów z udarem kryptogennym.9 Przedłużone, 30-dniowe monitorowanie EKG u osób po udarze kryptogennym 5-krotnie zwiększa szansę rozpoznania MP (16% vs 3,2%) w porównaniu ze standardowym 24-godzinnym badaniem holterowskim EKG.10 Wiele incydentów NMP nie jest odczuwanych przez chorych i dlatego preferuje się ciągłe monitorowanie, a nie rejestrator zdarzeń. Wykrywalność MP w przedłużonym monitorowaniu zwiększa się, gdy czas trwania napadu MP jest dłuższy. Pomimo intensywnej wczesnej diagnostyki u wielu pacjentów z udarem kryptogennym nie udaje się wykryć arytmii. Optymalny czas od momentu udaru do rozpoczęcia diagnostyki, metoda oraz długość monitorowania nie zostały dotychczas jednoznacznie ustalone. W celu ułatwienia identyfikacji chorych wysokiego ryzyka NMP zaproponowano kliniczne skale oceny charakteryzujące się zadowalającą czułością i swoistością diagnostyczną (tab. 2).11
Odsetek wykrywanych zaburzeń rytmu serca zwiększa się także przy zastosowaniu wszczepialnych rejestratorów pętlowych lub rejestratorów zdarzeń. W badaniu Crystal-AF wykazano, że u osób po udarze kryptogennym, u których nie stwierdzono MP na podstawie rutynowej diagnostyki, wszczepiony rejestrator umożliwił rozpoznanie NMP w ciągu 6 miesięcy u 8,9%, 12 miesięcy u 12,4% w porównaniu z odpowiednio 1,4 i 2% chorych monitorowanych za pomocą 24-godzinnego tradycyjnego holtera EKG.12 W grupie chorych wysokiego ryzyka nierozpoznanego NMP znajdują się pacjenci z implantowanym stymulatorem serca z powodu choroby węzła zatokowego lub bloku przedsionkowo-komorowego. W ciągu roku od implantacji u 24% z nich stwierdza się NMP.13 W przypadku UN u osoby z układem stymulującym serce należy zawsze sprawdzić pamięć urządzenia w poszukiwaniu nierozpoznanych dotychczas incydentów MP. Umożliwia to wykrycie NMP u 28% chorych.14 Rozpoznanie utrwalonego MP u chorych ze stymulacją komory w rutynowym EKG bywa utrudnione ze względu na stały miarowy rytm wystymulowanych zespołów QRS, zwłaszcza przy niskonapięciowej fali migotania przedsionków.