Przy podejrzeniu ostrego, pozagałkowego zapalenia nerwu II interpretacji podlegają zarówno latencja, jak i amplituda fali P100, co uwidoczniono na rycinie 4. Wydłużenie latencji o 10-30 ms (nawet >130 ms) i jej różnice międzyoczne są wiarygodniejszym wskaźnikiem ostrej dysfunkcji nerwu II niż wahania amplitud, które cechują się dużą zmiennością osobniczą5,11. Niejednokrotnie można zaobserwować subkliniczne wydłużenie latencji fali P100 w drugim, zdrowym oku, co pozwala zidentyfikować pacjentów, u których ryzyko rozwoju SM w przyszłości jest zwiększone13. Warto podkreślić, że w przebiegu pozagałkowego zapalenia nerwu II na tle SM amplituda fali (o ile była obniżona) normalizuje się w ciągu kilku tygodni wraz z poprawą ostrości wzroku, zaś wydłużenie latencji (ze względu na ograniczoną remielinizację aksonów) ustępuje powoli, nawet dwa lata lub dłużej12.
Przednia niedokrwienna neuropatia nerwu wzrokowego
Przednia niedokrwienna neuropatia nerwu wzrokowego (AION – anterior ischemic optic neuropathy) jest poważną przyczyną nagłego, jednoocznego zaniewidzenia z ubytkami w polu widzenia, która w 5-10% przypadków może przebiegać z olbrzymiokomórkowym zapaleniem tętnic. Badanie VEP jest wskazane szczególnie w nietypowych przypadkach AION (wiek <50 roku życia, dobra ostrość wzroku, niejednoznaczny obraz oftalmoskopowy, np. brak wydatnej bladości obrzękniętej tarczy nerwu II lub prawidłowy współczynnik cup/disc w oku towarzyszącym14).
Przeprowadzenie badań elektrofizjologicznych jest również uzasadnione przy podejrzeniu tylnej niedokrwiennej neuropatii nerwu wzrokowego (PION – posterior ischemic optic neuropathy), w której mamy do czynienia z prawidłowym wyglądem tarczy nerwu II. Wybór użytego do stymulacji bodźca zależy od współpracy chorego i jego ostrości wzroku (gdy najlepsza skorygowana ostrość wzroku wynosi <0,1, należy rozważyć FVEP zamiast preferowanych PVEP).

Rycina 5. PVEP zarejestrowane u pacjentki z przednią niedokrwienną neuropatią nerwu wzrokowego (AION). Uwagę zwracają zaburzenie morfologii zapisu (spłaszczenie) i znaczna redukcja amplitudy fali P100
Analizując parametry VEP w przebiegu AION, można zauważyć znaczną redukcję amplitudy fali P100 (często <3 µV), wynikającą z ischemii siatkówki centralnej, przy jednoczesnym zachowaniu prawidłowej (lub nieznacznie wydłużonej) latencji, odwrotnie niż w przypadku chorób demielinizacyjnych15,16. Przykład takiego nieprawidłowego zapisu przedstawiono na rycinie 5. Jeśli mroczek centralny jest duży (≥5°), zarejestrowanie odpowiedzi PVEP (z prawidłową identyfikacją załamka P100) jest praktycznie niemożliwe2,17. Wskutek ciężkiego niedokrwienia dochodzi do nieodwracalnej utraty komórek zwojowych siatkówki i zaniku ich aksonów, co znajduje odzwierciedlenie w utrzymujących się nieprawidłowych zapisach VEP po przebytym AION.
Zmiany uciskowe w obrębie przedniego odcinka drogi wzrokowej
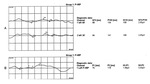
Rycina 6. PVEP i FVEP zarejestrowane u pacjenta z uciskiem nerwu wzrokowego lewego w następstwie nowotworu oczodołu. Uwagę zwracają zarówno wydłużenie latencji, jak i obniżenie amplitud fal
Wskutek kompresji i spowolnienia przewodnictwa neuronalnego dochodzi zarówno do wydłużenia latencji fali P, jak i obniżenia jej amplitudy (ryc. 6). Należy pamiętać, że w tej grupie chorych opóźnienie czasu kulminacji fali nie jest tak wydatne jak w przypadku neuropatii nerwu II o podłożu demielinizacyjnym. Podobnie redukcja amplitud fal nie jest tak wyraźna jak w przypadku głębokiej ischemii w przebiegu AION.
Badanie PVEP znajduje szerokie zastosowanie w monitorowaniu pacjentów z gruczolakami przysadki uciskającymi obszar skrzyżowania nerwów wzrokowych, pozwala wtedy wychwycić subkliniczne stadia uszkodzenia aksonów (nawet jeśli ostrość wzroku i perymetria pozostają prawidłowe)18. W przypadku ucisku włókien skrzyżowanych (nosowych) charakterystyczne jest wystąpienie w zapisie VEP asymetrii międzyocznej (tzw. crossed asymmetry distribution), korelującej z dwuskroniowymi ubytkami pola widzenia12,15,18. Uwidacznia to zapis typu pattern reversal z użyciem dużego bodźca o rozmiarze 50’, wymagający minimum dwukanałowego systemu odprowadzeń i trzech elektrod czynnych (umiejscowionych w punktach Oz oraz O1 i O2 wg ISCEV [patrz: ryc. 1]). W przypadku prezentowania wzorca szachownicy w zajętej połowie pola widzenia (hemi-field VEP) można zaobserwować zarówno wydłużenie latencji, jak i znaczną redukcję amplitud w porównaniu z nosową częścią pola widzenia, co wskazuje na włączenie włókien skrzyżowanych w proces chorobowy. Zarówno metoda hemi-field, jak i wspomniane wcześniej mfVEP są czasochłonne, ale cechują się wysoką czułością (sięgającą 85%) w wykrywaniu bardzo wczesnych uszkodzeń na poziomie skrzyżowania19.
Drugim schorzeniem, w którym zastosowanie VEP jest nie do przecenienia, jest orbitopatia tarczycowa. Regularne badania elektrofizjologiczne pozwalają na obiektywną ocenę progresji neuropatii nerwu II i podjęcie decyzji co do interwencji chirurgicznej w celu zapobieżenia trwałej utracie widzenia.
Albinizm
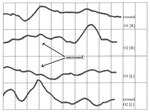
Rycina 7. Schemat odprowadzeń dwupółkulowych (O1 i O2 wg ISCEV) w badaniu FVEP u osoby z albinizmem. Pobudzenie każdego oka osobno skutkuje wyraźną asymetrią dystrybucji z dominującą odpowiedzią z półkuli przeciwstronnej (np. prawej: O2) do pobudzanego oka (lewego: [L]). Strzałkami zaznaczono obniżenie amplitudy odpowiedzi z włókien nieskrzyżowanych (uncrossed), w porównaniu ze wzmożoną odpowiedzią z włókien skrzyżowanych (crossed). Badanie zostało wykonane w Klinice Okulistyki Uniwersyteckiego Centrum Klinicznego im. prof. K. Gibińskiego Śląskiego Uniwersytetu Medycznego w Katowicach
U zdrowych osób proporcja włókien skrzyżowanych do nieskrzyżowanych wynosi w przybliżeniu 55:45. W przypadku osób dotkniętych albinizmem odsetek włókien skrzyżowanych, zmierzających do przeciwległej półkuli, jest większy (≥80%). Ma to odzwierciedlenie w charakterystycznej dla tego schorzenia nieprawidłowej dystrybucji odpowiedzi VEP, co jest rozstrzygające w przypadkach niejasnych klinicznie (brązowe włosy, dyskretna iluminacja tęczówki). Przeprowadzenie badania wymaga wielokanałowego systemu odprowadzeń (znad prawej i lewej półkuli mózgu, według protokołu ISCEV) i ujawnia asymetryczną lateralizację, tj. dominację odpowiedzi z półkuli przeciwstronnej do pobudzanego oka20, co zaprezentowano schematycznie na rycinie 7. Preferuje się stymulacje bodźcem błyskowym (u osób <6 roku życia, niewspółpracujących, z głębokim niedowidzeniem lub z nasilonym oczopląsem), a jeśli zdecydujemy się na PVEP, zalecana jest prezentacja w trybie onset-offset21.
Pozostałe stany, w których badania VEP są uzasadnione
Toksyczne neuropatie nerwu II
W tych przypadkach możemy się spodziewać nieprawidłowości w parametrach VEP, nawet gdy chory nie zgłasza żadnych skarg, a wyniki badań oftalmoskopowych są prawidłowe. W zapisie PVEP dominuje obniżenie amplitudy fali P100, któremu towarzyszy (choć nie musi) wydłużenie jej latencji. Nie są to cechy patognomoniczne dla konkretnej grupy substancji, ale użyteczne w monitorowaniu osób z niedoborami witamin, na przykład B12, przyjmujących przewlekle etambutol, chlorochinę, etanercept, amiodaron lub podejrzanych o zatrucie metalami ciężkimi bądź metanolem22.
Choroba Alzheimera
Ze względu na degenerację między innymi wielkokomórkowego szlaku wzrokowego (magnocellular pathway) dochodzi do nieprawidłowości w zapisie VEP. Specyficzne dla choroby Alzheimera jest wydłużenie latencji fali P2 podczas badania FVEP (przy zachowany prawidłowym komponencie P1). Wydłużenie latencji i obniżenie amplitudy fali P100 w PVEP ujawnia się silniej, gdy zastosujemy stymulację barwnym wzorcem blue-yellow23. Badając pacjentów z chorobami neurodegeneracyjnymi, należy pamiętać, że odchylenia w parametrach VEP mogą pojawić się jako konsekwencje podeszłego wieku, schorzeń współtowarzyszących (w tym okulistycznych) i polifarmakoterapii.
Ślepota korowa
Ślepota korowa to utrata widzenia w obojgu oczach (z zachowaniem reakcji źrenic na światło i do bliży) wskutek obustronnego uszkodzenia kory wzrokowej. Przydatność badania VEP jest kontrowersyjna, zapis jest zwykle wygaszony, ale zdarzają się przypadki prawidłowego obrazu mimo potwierdzonego uszkodzenia płatów potylicznych. Jest to prawdopodobnie spowodowane defektem asocjacyjnej kory wzrokowej (pole 18 i 19) lub zachowaniem niewielkiego funkcjonalnego obszaru prążkowia, który jest wystarczający do wywołania odpowiedzi bioelektrycznej, ale niedostateczny dla prawidłowej percepcji24.