Najważniejszym wynikiem przeprowadzonych badań jest wykazanie, że leczenie 223Ra wpływa na przedłużenie czasu przeżycia i czasu do progresji choroby. Wyniki badania wykazały statystycznie istotnie dłuższy całkowity czas przeżycia (2,8 miesiąca) w grupie chorych leczonych 223Ra, w porównaniu z grupą placebo.
Wyniki badania ALSYMPCA potwierdziły także skuteczność 223Ra w zakresie uśmierzenia bólu. Radiofarmaceutyk ten jest pierwszym zawierającym emiter promieniowania α oficjalnie zarejestrowanym i dopuszczonym do leczenia.
Nowe, potencjalne wskazania dla emiterów alfa
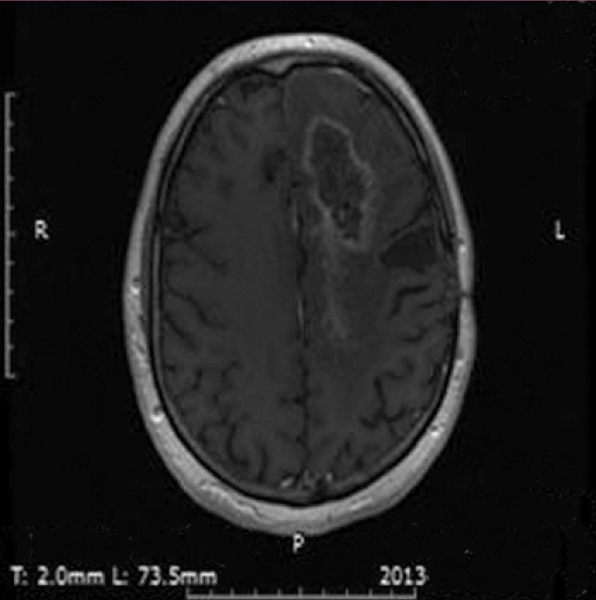
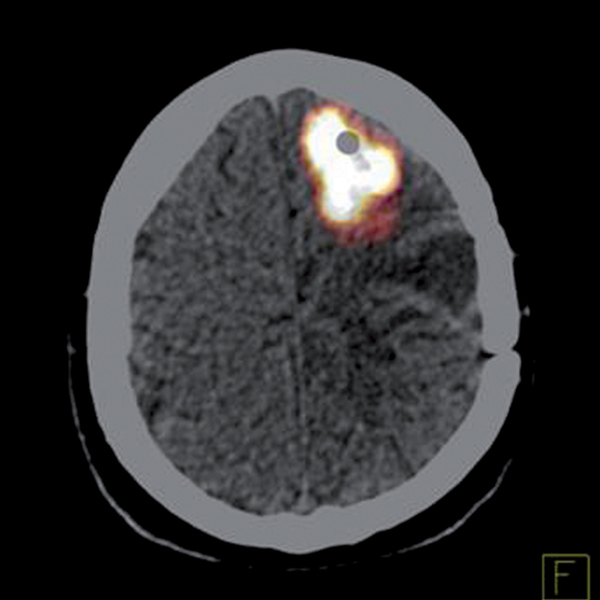
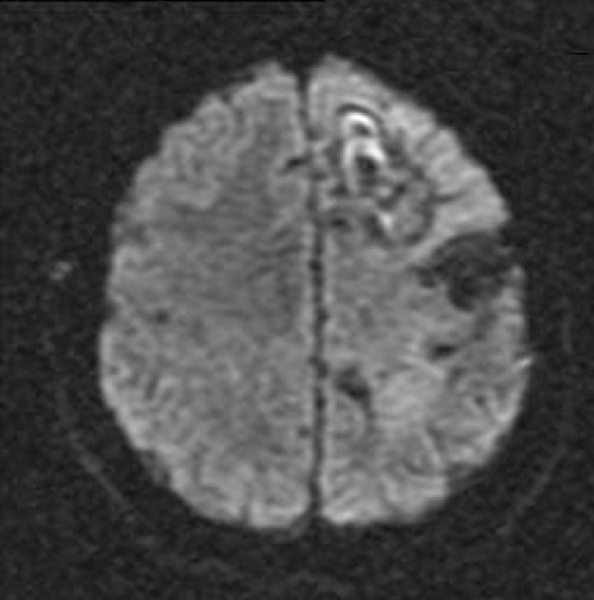
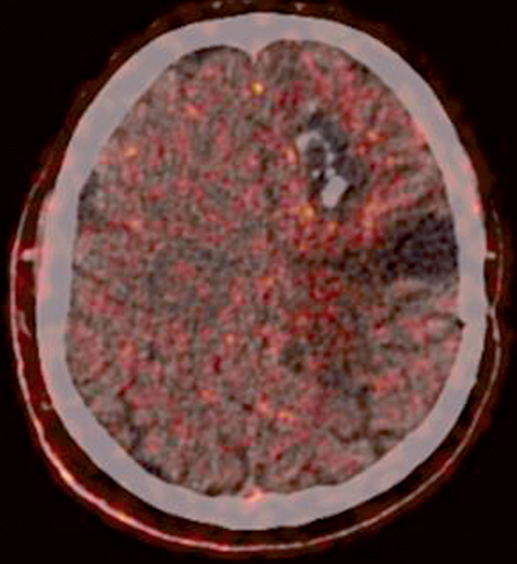
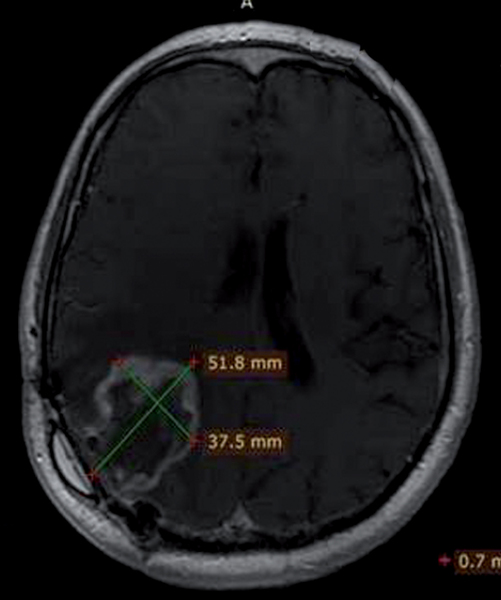
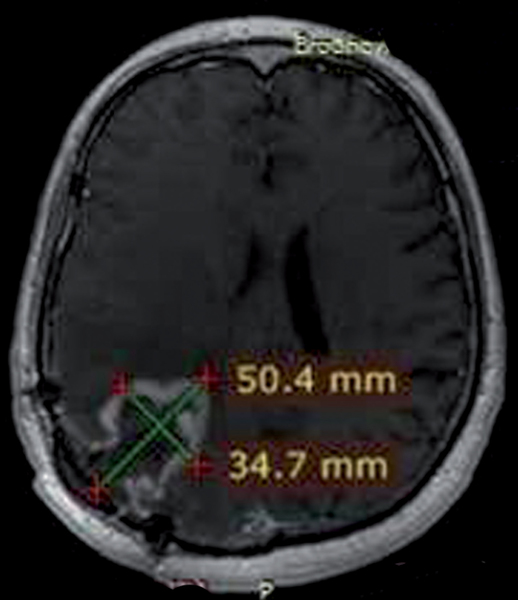
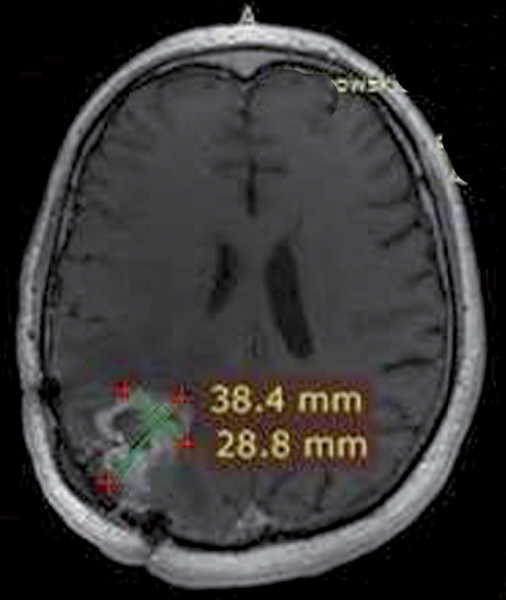
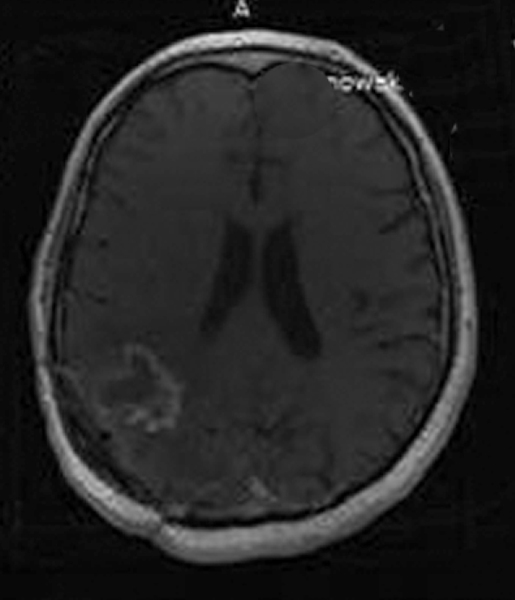
W naszej klinice, w ramach badania klinicznego, stosujemy emitery α u chorych na glejaki (ryc. 1-12).
Obecnie terapią objętych jest 25 pacjentów, u których rozpoznano wznowę guza, po uprzednim leczeniu operacyjnym, radio- i chemioterapii; u każdego chorego stwierdzono w badaniu histologicznym III lub IV stopnień złośliwości guza wg skali WHO. Średni czas przeżycia w tej grupie chorych – według piśmiennictwa – wynosi od trzech do sześciu miesięcy. Metoda polega na podaniu do loży pooperacyjnej znakowanej bizmutem (213Bi) substancji P. Uprzednio wykazano, że ekspresja układu receptorowego dla tego białka jest znacznie zwiększona w komórkach nowotworowych glejaków, niezależnie od stopnia jego złośliwości. Obecnie na ocenę efektów leczenia jest jeszcze za wcześnie. Przewidujemy jednak, że osiągniemy wydłużenie czasu przeżycia i czasu wolnego od progresji.
Zaletą miejscowego podawania radiofarmaceutyku jest niemal całkowite wyeliminowanie działania leku na inne narządy oraz ominięcie efektu bariery krew-mózg, co stanowi jeden z ważniejszych problemów w stosowaniu chemioterapii.
Innym zastosowaniem, które także ma formę eksperymentu klinicznego, jest α-radioimmunoterapia w leczeniu raka pęcherza moczowego, przy użyciu znakowanych przeciwciał monoklonalnych 213Bi-anty-EGFR. Obecnie tylko jeden z ośrodków niemieckich rozpoczął leczenie pierwszych chorych tą metodą. Rak pęcherza moczowego ograniczony do błony śluzowej, mimo elektroresekcji, często ulega wznowie. U 15-40 proc. pacjentów stwierdza się wznowę procesu w ciągu pięciu lat, pomimo adjuwantowej chemioterapii dopęcherzowej. Wydaje się, że proponowana metoda jest obiecującą opcją terapeutyczną dla pacjentów z rakiem pęcherza moczowego, mającą na celu głównie zmniejszenie ryzyka nawrotów po leczeniu endoskopowym.
Trwają też badania nad zastosowaniem emiterów α w przerzutach nowotworowych guzów neuroendokrynnych do wątroby znakowanymi radioizotopowo analogami somatostatyny. Jak zaznaczono uprzednio, mamy już doświadczenie w stosowaniu promieniowania β w tej jednostce chorobowej.
Metoda polega na podawaniu dotętniczym (do tętnicy wątrobowej) analogów somatostatyny znakowanych emiterami α. Technika ta jest szczególnie polecana, jeśli u chorego stwierdza się bardzo liczne, małe przerzuty wywodzące się z guza typu neuroendokrynnego. W przeszłości próbowano stosować emitery α w terapii czerniaka i raka jajnika.
Dodatkowym argumentem wskazującym na przewagę emiterów α nad β emiterami jest znacznie większe bezpieczeństwo radiologiczne. Leczenie nie wymaga tak kosztownych inwestycji w celu zapewnienia warunków ochrony radiologicznej, jakie są ponoszone w przypadku stosowania innych emiterów promieniowania jonizującego. Wystarczające osłabienie promieniowania α zapewnia już kartka zwykłego papieru.
Ograniczenia metody
Zagadnieniami wymagającymi dalszych badań jest przede wszystkim wprowadzenie bardziej swoistych radiofarmaceutyków i sposobu ich podawania, które pozwolą na skuteczniejszą terapię radioizotopową. Rozważane są także metody łączenia chemioterapii i terapii radioizotopowej, celem zwiększenia wrażliwości komórek nowotworowych na promieniowanie jonizujące. Innym zagadnieniem jest także określenie wytycznych dozymetrycznych pozwalających na przewidywanie efektów leczenia. Kolejnym problemem jest miejsce włączenia leczenia radioizotopowego w uznanym schemacie leczenia. Przykładem jest choćby leczenie glejaków mózgu. Czy powinno być ono prowadzone dopiero wtedy, gdy obserwuje się wznowę procesu chorobowego, czy też bezpośrednio po zastosowaniu radio- i chemioterapii, przed stwierdzeniem wznowy choroby nowotworowej?
Musimy też pamiętać, że to, co dziś widzimy za pomocą wyspecjalizowanych urządzeń diagnostycznych, jest zaledwie wierzchołkiem góry lodowej. Coraz więcej dowodów wskazuje na istnienie nowotworowych komórek macierzystych (cancer stem cells), czyli populacji niezróżnicowanych, samoodnawiających się komórek w guzie nowotworowym, które są odpowiedzialne za wznowę choroby i przerzuty nowotworowe. Podobnie jak zwykłe komórki macierzyste (stem cell), zlokalizowane są one w otoczeniu innych komórek organizmu, skąd otrzymują sygnały do różnicowania i proliferacji. Zaburzenia w szlakach sygnałowych między nimi mogą z kolei prowadzić do ich niekontrolowanych podziałów i zasiedlania nowych obszarów ciała (przerzuty).
Wszystko to wymusza na nas zmianę sposobu myślenia na temat terapii przeciwnowotworowej i ukierunkowanie działań również na ten rodzaj komórek. Być może skutecznym orężem w tej walce będą właśnie emitery α, które sprawdziły się już w terapii niektórych chorób nowotworowych. Można więc przypuszczać, że będą one ciekawą alternatywą lub uzupełnieniem tradycyjnych metod terapii przeciwnowotworowej, także w innych, niezbadanych jeszcze, wskazaniach.
Przypadek 1
Chory w wieku 26 lat został przyjęty do szpitala w czerwcu 2011 roku z powodu napadu padaczkowego. W badaniu MRI rozpoznano guz lewej okolicy czołowo-ciemieniowej. Operowany w lipcu 2011 roku. W badaniu histopatologicznym rozpoznano guz typu gwiaździaka (II stopień złośliwości). Następnie zakwalifikowany do radioterapii. W trakcie chemioterapii wystąpiły powikłania w postaci małopłytkowości. Z tego względu odstąpiono od dalszego leczenia.
We wrześniu 2012 roku ponownie operowany z powodu podejrzenia wznowy choroby. W badaniu histopatologicznym rozpoznano gwiaździak III stopnia złośliwości. Z tego względu został zakwalifikowany do leczenia 213Bi- Substancji P. Pierwszą dawkę 213Bi-Substancji P podano w grudniu 2012 roku. W sumie chory otrzymał osiem dawek radiofarmaceutyku co dwa miesiące. Stan kliniczny w skali Karnofsky’ego wynosi 80, w skali Barthela – 95. Chory pozostaje w obserwacji, podjął pracę zawodową.
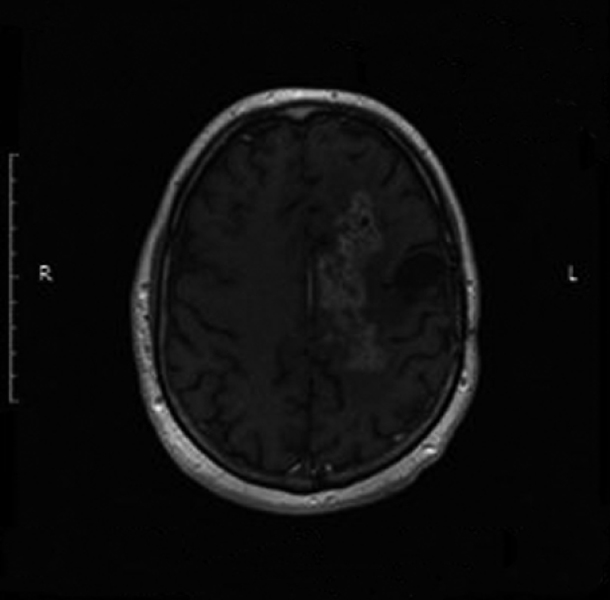
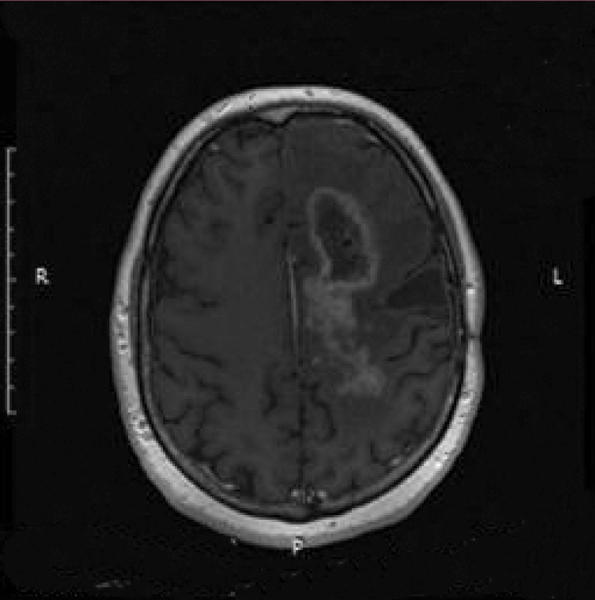
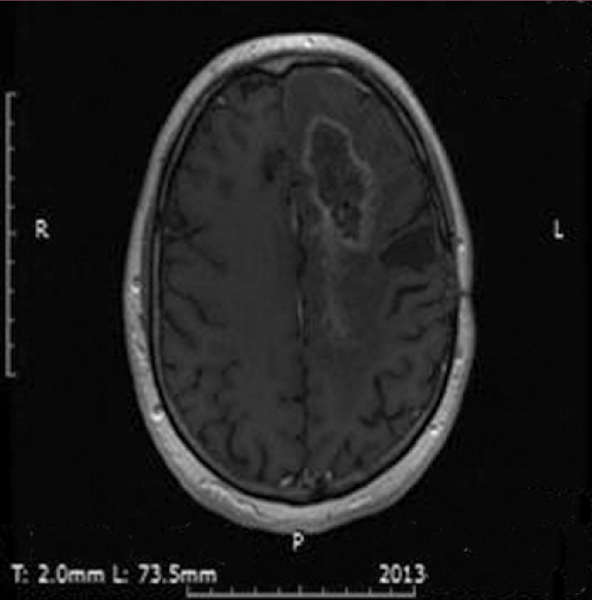
Kolejne obrazy przedstawiają redukcję wielkości guza w trakcie leczenia.
Przypadek 2
Chory w wieku 58 lat został przyjęty do szpitala z powodu pierwszego napadu padaczkowego w październiku 2011 roku. W badaniu MRI stwierdzono obecność guza prawej okolicy ciemieniowej. Chory został zakwalifikowany do leczenia operacyjnego. Operację przeprowadzono w listopadzie 2011 roku. Na podstawie badania histopatologicznego rozpoznano glejak wielopostaciowy (IV stopień złośliwości). Po operacji chory leczony był z zastosowaniem radio- i chemioterapii.
W lutym 2012 roku wystąpiły ponownie napady padaczkowe i zaburzenia świadomości. Na podstawie objawów klinicznych i badania MRI stwierdzono wznowę procesu nowotworowego. Chorego zakwalifikowano do leczenia z zastosowaniem 213Bi-Substancji P.
W kwietniu 2012 roku przeprowadzono ponowną operację w celu usunięcia guza i implantacji cewnika w loży pooperacyjnej. Po zagojeniu się rany w maju 2012 roku rozpoczęto leczenie radioizotopowe. Co dwa miesiące podawano kolejne dawki 213Bi-Substancji P. W grudniu 2013 roku przeprowadzono ponowną operację z powodu podejrzenia wznowy. W badaniu histopatologicznym stwierdzono cechy martwicy guza. Po operacji kontynuowano leczenie. W sumie podano sześć dawek radiofarmaceutyku. W grudniu 2013 roku chory doznał urazu głowy, rozpoznano krwiak śródmózgowy. Zmarł w czerwcu 2014 roku. Czas przeżycia chorego z rozpoznaniem wznowy glejaka wielopostaciowego, po uprzednim leczeniu operacyjnym, radio- i chemioterapii, wyniósł 25 miesięcy. W piśmiennictwie czas przeżycia określa się średnio na sześć miesięcy. Stan chorego określany w skali Karnofsky’ego wynosił w trakcie leczenia 70, w skali Barthela – 95.
Kolejne obrazy przedstawiają wyniki badań MRI.