Opis przypadku
Atypowa przewlekła białaczka szpikowa leczona azacytydyną
Lek. Katarzyna Godlewska
Atypowa przewlekła białaczka szpikowa jest rzadką chorobą mieloproliferacyjną BCR-ABL(-). Istotnym problemem w jej leczeniu jest brak ustalonego standardu postępowania. Przedstawiamy przypadek pacjenta z aCML leczonego azacytydyną, który po 6 cyklach chemioterapii osiągnął częściową remisję.
Opis przypadku
55-letni pacjent z wywiadem nadciśnienia tętniczego, cukrzycy typu 2, z istotną stenozą aortalną kwalifikowaną do zabiegu kardiochirurgicznego, został skierowany do kliniki hematologii z powodu podejrzenia choroby mieloproliferacyjnej układu krwiotwórczego. Przy przyjęciu pacjent zgłaszał pogorszenie tolerancji wysiłku od ok. 3 miesięcy. W badaniu przedmiotowym z odchyleń od stanu prawidłowego stwierdzono szmer skurczowy nad zastawką aortalną. W badaniach laboratoryjnych stwierdzono leukocytozę (WBC 24,5 tys.) z przesunięciem obrazu odsetkowego do metamielocyta, niedokrwistość (Hb 7,4 g/dl), małopłytkowość (Plt 83 tys.). W mielogramie układ białokrwinkowy względnie obniżony, przesunięcie w lewo do promielocyta, komórki blastyczne ok. 1,4 proc. W trepanobioptacie obraz odpowiadający utkaniu w przebiegu choroby mieloproliferacyjnej z cechami stwardnienia. W trakcie hospitalizacji wykonano także badanie cytogenetyczne (kariotyp prawidłowy) oraz badanie molekularne (BCR-ABL ujemny, JAK2 – ujemny, MPL egzonu 10 – ujemny). Na podstawie wykonanych badań rozpoznano atypową przewlekłą białaczkę szpikową. Z uwagi na brak wskazań do chemioterapii pacjent wypisany do domu z zaleceniem regularnych kontroli w poradni hematologicznej.
Trzy miesiące później pacjent ponownie skierowany do kliniki w celu włączenia leczenia. Stwierdzono powiększoną śledzionę ok. 3 cm poniżej łuku żebrowego. W trakcie hospitalizacji przetoczono preparaty krwiopochodne (Hb 7,2 g/dl) oraz włączono interferon α. Chory leczony interferonem α przez 3 tygodnie, 30 czerwca 2017 roku lek odstawiono z powodu nietolerancji.
7 lipca 2017 roku pacjent przyjęty do kliniki w celu zmiany linii leczenia. Przedmiotowo stwierdzono cechy anemizacji, utrzymującą się splenomegalię, szmer skurczowy nad zastawką aortalną. W morfologii krwi obwodowej niedokrwistość (Hb 6,2 g/dl), małopłytkowość (Plt 46 tys.). W trakcie hospitalizacji wykonano biopsję szpiku (blasty 0,6% przesunięcie w lewo do promielocyta). Chorego zakwalifikowano do leczenia azacytydyną. Przetoczono siedem jednostek NUKKCz oraz podano darbepoetynę. Po czterech cyklach chemioterapii uzyskano częściową rekonstytucję parametrów morfologii krwi (Hb 8,7 g/dl, Plt 87 tys., WBC 3,33 tys.). Termin zabiegu kardiochirurgicznego (CABG z wymianą zastawki aortalnej) ustalono na listopad 2017 roku.
21 listopada 2017 roku pacjent przyjęty do kliniki hematologii w trybie nieplanowym z powodu pogorszenia stanu ogólnego. Przy przyjęciu stan średniociężki, chory zgłaszał ogólne osłabienie, bóle mięśniowo-stawowe. Z odchyleń od stanu prawidłowego stwierdzono stan po CABG, bladość powłok skórnych, wzdęcie brzucha ze wzmożonym napięciem mięśniowym. W morfologii krwi obwodowej leukocytoza (WBC 187 tys.), Hb 9,2 g/dl, Plt 37 tys. Z uwagi na zgłaszane dolegliwości wykonano w trybie pilnym TK jamy brzusznej, która wykazała znaczną splenomegalię 72 x 226 mm zwężającą światło okrężnicy w okolicy zgięcia wątrobowego. Odcinki jelita grubego położone proksymalnie znacznie poszerzone, zawierające dużą ilość gazu i mas kałowych (ryc. 1, 2a-c). Chory konsultowany chirurgicznie – stosowano lewatywy mydlane, dietę „0”, nawodnienie dożylne, uzyskując ustąpienie dolegliwości. W posiewie moczu stwierdzono wzrost Klebsiella pneumoniae ssp pneumoniae, szczep oporny na kolistynę – w leczeniu stosowano szerokowachlarzową antybiotykoterapię (meropenem, ertapenem, amikacyna, wankomycyna). W kontrolnym badaniu echokardiograficznym EF 58 proc. Po normalizacji stanu klinicznego pacjenta w leczeniu włączono hydroksykarbamid, uzyskując zmniejszenie leukocytozy do 90 tys. Następnie pacjenta zakwalifikowano do kolejnego cyklu azacytydyny, powikłań nie obserwowano. Z uwagi na utrzymującą się małopłytkowość odstąpiono od terapii przeciwpłytkowej, utrzymano HDCz w dawce 20 mg.
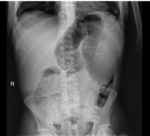
Ryc. 1. RTG jamy brzusznej, na zdjęciu widoczne spadnięte jelito cienkie, rozdęte jelito grube zawierające masy kałowe.
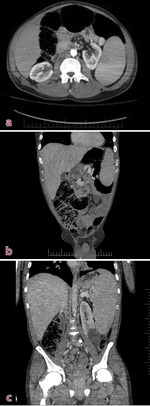
Ryc. 2a-c. Tomografia jamy brzusznej, na zdjęciach widoczna znaczna splenomegalia, poszerzone jelito grube zawierające dużą ilość gazu i mas kałowych.
Obecnie pacjent po sześciu cyklach azacytydyny. Przed ostatnim cyklem stwierdzono poprawę parametrów morfologii (Hb 9,5 g/dl, WBC 37 tys., Plt 53 tys.).
Dyskusja
Atypowa przewlekła białaczka szpikowa (aCML) jest rzadką chorobą mieloproliferacyjną z BCR-ABL(-). Problemy diagnostyczne z tą jednostką chorobową są związane z odrębnością cech klinicznych i genetycznych, wysokiego ryzyka transformacji do ostrej białaczki szpikowej oraz niskiego poziomu przeżycia.[1]
W przeciwieństwie do CML, w której obecność chromosomu Ph jest mutacją definiującą tę jednostkę chorobową, w aCML żadna pojedyncza zmiana genetyczna nie stanowi podstawy do rozpoznania. Niemniej jednak wyróżniono geny o większej częstości występowania, które obejmują: SETBP1, ASXL1, N/K-RAS, SRSF2 i TET2 oraz mutacje o mniejszej częstości: CBL, CSF3R, JAK2, ETNK1.[1,2,3,4]
Obecnie nie istnieje żaden udokumentowany standard postępowania z aCML, dlatego allogeniczne przeszczepienie komórek macierzystych powinno stanowić podstawę leczenia.[1]
Ruksolutynib, inhibitor kinazy JAK2 obecnie zarejestrowany do leczenia mielofibrozy i czerwienicy prawdziwej z progresją do mielofibrozy, może być rozważony jako opcja terapeutyczna u pacjentów z aCML. Identyfikacja genu CSF3R T618l oraz JAK2 V617F daje możliwość zastosowania inhibitorów kinazy JAK2.[1] Kim Hien T. Dao i wsp. opisali przypadek pacjenta z aCML oporną na hydroksykarbamid z mutacją CSF3R, u którego zastosowano ruksolutynib. W wyżej wymienionym przypadku uzyskano poprawę parametrów morfologii krwi obwodowej (redukcja leukocytozy, wzrost Hb i liczby płytek krwi) oraz zmniejszenie splenomegalii. Godne uwagi jest to, że poprawa kliniczna nie była związana z redukcją CSF3R.[5]
Kolejną opcją terapeutyczną są leki hipometylujące. Dr J. Gotlib rozważa ich zastosowanie w dwóch przypadkach:
- jako samodzielna linia leczenia,
- jako leczenie pomostowe przed alloHSCT.[1]
Mao L. i WSP., Tong X i wsp., Haussmann H i wsp., Jiang H i wsp.[6,7,8,9] opisali w sumie 8 pacjentów z aCML leczonych decytabiną w dawce 20 mg/m2/dobę iv. przez 5 dni. 7 z 8 chorych osiągnęło całkowitą remisję hematologiczną, 2 pacjentów zakwalifikowano do allo-HSCT. Jeden z nich zmarł w 49. dniu po przeszczepie w wyniku GVHD oraz niewydolności wielonarządowej. Podsumowując, doświadczenia związane z zastosowaniem leków hipometylujących są ograniczone i nie mogą być uznane za standard postępowania.[1]
Wśród innych leków, które w przyszłości mogą stanowić opcję terapeutyczną w leczeniu aCML, należy wymienić inhibitor kinazy MEK1/MEK2: trametynib, modulatory spliceosomów i fingolimod.[1]
