Dysplazja oskrzelowo-płucna
Ewa Helwich
Słowa kluczowe
dysplazja oskrzelowo-płucna, noworodek przedwcześnie urodzony, wentylacja mechaniczna
Wprowadzenie
Dysplazja oskrzelowo-płucna (bronchopulmonary dysplasia, BPD) jest chorobą występującą u noworodków urodzonych przedwcześnie z ekstremalnie małą (extremaly low birthweight, ELBW) i bardzo małą masą ciała (very low birthweight, VLBW). Jej nasilenie w okresie noworodkowym może być różne, co decyduje o postępowaniu leczniczym stosowanym w trakcie hospitalizacji pourodzeniowej oraz w późniejszym okresie życia.
Definicja
Definicja dysplazji oskrzelowo-płucnej została stworzona po raz pierwszy przez Northwaya w 1967 r., choć przypuszcza się, że opisywany kilka lat wcześniej zespół Wilsona-Mikity odpowiadał temu schorzeniu.1,2 Obecnie obraz choroby odbiega od pierwotnego opisu. Zmiany w postępowaniu okołoporodowym w przypadkach porodów przedwczesnych, najnowsze zdobycze nauki i techniki medycznej sprawiły, że przeżywają znacznie bardziej niedojrzałe noworodki niż kilkadziesiąt lat temu. Obecnie dysplazja oskrzelowo-płucna niezwykle rzadko dotyczy bardziej dojrzałych noworodków z masą ciała zbliżoną do 2000 g, występuje natomiast w populacji tych skrajnie niedojrzałych, urodzonych przed ukończeniem 28 tygodni ciąży, z masą ciała poniżej 1000 g. W obrazie choroby przestały dominować zmiany włókniste, na pierwszy plan wysuwa się zahamowanie procesu tworzenia pęcherzyków płucnych (czyli zahamowanie alweoryzacji) i obecność powiększonych pęcherzyków płucnych. Dzięki najnowszej definicji choroby opracowanej przez Jobego możliwa jest jej klasyfikacja w zależności od nasilenia zmian.3 Postać łagodna BPD dotyczy niemowląt, które wymagały wzbogacania mieszaniny oddechowej w tlen przez 28 dni ich życia. Postać umiarkowana jest rozpoznawana u dzieci wymagających tlenu w stężeniu poniżej 30% w 36 tygodniu wieku postkoncepcyjnego. Postać ciężka występuje u dzieci wymagających stosowania tlenu w stężeniu przynajmniej 30% lub stałego dodatniego ciśnienia w drogach oddechowych (continous positive airway pressure [CPAP] – w postaci wentylacji mechanicznej lub donosowej) w 36 tygodniu wieku postkoncepcyjnego.
Częstość występowania
Częstość występowania BPD jest odwrotnie proporcjonalna do dojrzałości i urodzeniowej masy ciała noworodka. Występuje u 76% dzieci urodzonych przed ukończeniem 27 tygodnia ciąży, u 32,3% urodzonych między 27 a 29 tygodniem, u 10% między 29 a 31 tygodniem i u nieco ponad 3% urodzonych między 31 a 33 tygodniem ciąży.4,5Dysplazja oskrzelowo-płucna znalazła się na światowej liście chorób rzadkich.
Etiologia
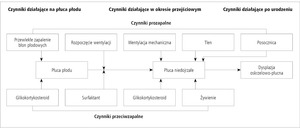
Zmiany prowadzące do dysplazji oskrzelowo-płucnej rozpoczynają się najczęściej między 23 a 28 tygodniem wieku postkoncepcyjnego, około 1 miesiąca po zakończeniu podziału dróg oddechowych i 3 miesiące przed rozpoczęciem tworzenia pęcherzyków płucnych.3 Do rozwoju choroby przyczynia się proces zapalny w postaci zapalenia owodni (chorioamnionitis), często obecny przy przedwczesnym urodzeniu. Najczęściej jest to proces przebiegający subklinicznie, a rozpoznanie opiera się na obrazie histologicznym łożyska. Do identyfikowanych drobnoustrojów, związanych z zapaleniem błon płodowych, należą: Ureoplasma i Mycoplasma sp.6 Z badań wynika, że obecność Ureoplasma w wymazach bakteriologicznych pobranych z tchawicy noworodka kilkakrotnie zwiększa ryzyko BPD.7 Dokładne przewidywanie określonego ryzyka zachorowania na BPD na podstawie informacji o przebytym zapaleniu owodni nie jest jednak zwykle możliwe z uwagi na złożony charakter wzajemnych zależności (rycina).
Na rycinie przedstawiono czynniki, które w okresie okołoporodowym zwiększają lub zmniejszają ryzyko dysplazji oskrzelowo-płucnej. Do czynników prenatalnych zmniejszających ryzyko wystąpienia BPD u dziecka należą glikokortykosteroidy zastosowane przy zagrażającym porodzie przedwczesnym. Przenikając przez łożysko do płodu przyspieszają dojrzewanie płuc, redukując niewydolność oddechową po urodzeniu, która wymagałaby zastosowania uszkadzającej niedojrzałe płuca sztucznej wentylacji o wysokich parametrach oddechowych. W Polsce brakuje danych dotyczących faktycznej częstości stosowania steroidów w populacji noworodków urodzonych przedwcześnie, ale z danych szacunkowych wynika, że jest to ciągle jeszcze zbyt rzadko wykorzystywany, łatwo dostępny środek profilaktyki wielu powikłań porodu przedwczesnego.
Rodzaj zastosowanej resuscytacji pourodzeniowej w przypadku noworodka urodzonego przedwcześnie, którego płuca mają małą pojemność całkowitą i niedojrzałą budowę, może wpłynąć na wzrost ryzyka zachorowania na BPD, dlatego krótki okres pourodzeniowy (ok. 15 min) jest niezwykle istotny. Podatność płuc u noworodka urodzonego przedwcześnie jest zmienna, wymaga on wentylacji dodatnim ciśnieniem końcowowydechowym. Zbyt duże objętości oddechowe prowadzą do rozedmy śródmiąższowej. Nadmierne rozciągnięcie płuc może spowodować proces zapalny uszkadzający płuca, podobnie jak zbyt duże stężenia tlenu w mieszaninie oddechowej ze względu na zbyt słabo rozwinięte mechanizmy przeciwutleniające.8 Stosowanie resuscytacji oddechowej z użyciem aparatu Neopuff, zamiast worka samorozprężalnego typu Ambu, pozwala na kontrolowane stosowanie ciśnienia wdechowego i podawanie mniejszych objętości oddechowych. Unikanie hiperwentylacji jest koniecznym pierwszym etapem pozwalającym na uniknięcie uszkodzenia płuc.3 Im więcej uszkodzeń płuc u noworodka urodzonego przedwcześnie, tym większe prawdopodobieństwo rozwoju BPD. Wyniki wielu prac wskazują, że stosowanie techniki CPAP może powodować mniejsze uszkodzenie płuc niż wentylacja mechaniczna. Zastosowanie CPAP przed przekazaniem noworodka z sali porodowej na oddział intensywnej terapii w wielu przypadkach pozwala uniknąć intubacji. Mamy w tym zakresie także polskie doświadczenia.2
Optymalnemu postępowaniu okołoporodowemu w przypadku porodów przedwczesnych sprzyja trójstopniowy system opieki, jaki obowiązuje w Polsce. Zakłada on transport „w macicy”, poród na najwyższym, trzecim poziomie opieki, a więc tam, gdzie znajduje się doświadczony zespół położniczo-noworodkowy. Jak wynika z danych zbieranych przez Instytut Matki i Dziecka w Warszawie, jedynie ok. 60% dzieci z ELBW rodzi się tam, gdzie powinno, tj. w szpitalach referencyjnych trzeciego poziomu opieki perinatalnej.9 Ma to określone negatywne konsekwencje w postaci konieczności transportu karetką „N”, a także braku specjalistycznej opieki bezpośrednio po urodzeniu.
Jak już wspomniano, zastosowanie dodatniego ciśnienia końcowowydechowego (positive end expiratory pressure, PEEP) oraz donosowego CPAP od urodzenia może pozwolić na uniknięcie intubacji noworodka i sztucznej wentylacji.10 Narażenie na wspomaganie oddychania za pomocą wentylacji mechanicznej, uszkadzającej niedojrzałe struktury płuc, jest podstawową (obok skróconego wieku ciążowego) przyczyną BPD. Nowe techniki wentylacji, takie jak wentylacja oscylacyjna o wysokiej częstotliwości (high frequency oscillatory ventilation, HFOV), nie zmniejszyły ryzyka dysplazji u skrajnie niedojrzałych noworodków.11 Częstość dysplazji oskrzelowo-płucnej się nie zmieniła, ale mniejsze jest nasilenie zmian powstających w płucach.12
Niedojrzałe płuca noworodków z bardzo małą i ekstremalnie małą masą ciała cechuje częsty niedobór surfaktantu. Zgodnie z międzynarodowym konsensusem zalecane jest profilaktyczne podanie surfaktantu bezpośrednio po urodzeniu noworodkom w wieku ciążowym <26 tygodni lub >27 tygodni, które wymagają intubacji, lub jeśli u matki nie zastosowano przed porodem glikokortykosteroidów.13 Leczniczy tryb podania surfaktantu jest rekomendowany w przypadkach zapotrzebowania na tlen w stężeniu przekraczającym 30%.14W ostatnich latach w wielu ośrodkach rozwinięto techniki dotchawiczego podawania surfaktantu w czasie krótkotrwałej intubacji (technika INSURE) lub za pomocą cewnika zakładanego w laryngoskopie, bez konieczności intubacji.15,16 Uzupełnianie niedoborów surfaktantu w niedojrzałych płucach ma na celu uniknięcie występowania ciężkich zespołów niewydolności oddechowej, które wymagają agresywnego leczenia i grożą poważnymi powikłaniami. Surfaktant, stosowany profilaktycznie lub leczniczo, zmniejsza ryzyko występowania BPD.
Prawidłowe żywienie i uzyskiwane dzięki temu odżywienie adekwatne do wieku postkoncepcyjnego zmniejszają ryzyko BPD (patrz rycina). Żywienie po przedwczesnym urodzeniu optymalnie powinno być utrzymane na poziomie żywienia wewnątrzmacicznego, tzn. powodować przyrost masy ciała 15 g/kg/24 h. W praktyce tym dzieciom trudno jest zapewnić takie tempo wzrastania, co często prowadzi do „hipotrofii zewnątrzmacicznej”.
Właściwy sposób żywienia ma także istotne znaczenie w leczeniu dysplazji. Podkreśla się znaczenie podaży białka, która powinna wg zaleceń European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) wynosić optymalnie 3,5-4,0 g/kg/24 h i być rozpoczęta niezwłocznie po urodzeniu. Nawet niewielki deficyt białka spowalnia wzrastanie – wzrost masy ciała jest funkcją liniową dziennej podaży białka aż do 4,5 g/kg. Podaż lipidów dostarczających energię i długołańcuchowe wielonienasycone kwasy tłuszczowe (long chain poly-unsaturated fatty acids, LCPUFA), niezbędne do rozwoju istoty szarej mózgu i siatkówki oka, należy rozpocząć tak wcześnie, jak to możliwe.17
U noworodków urodzonych przedwcześnie stężenie witaminy A przy urodzeniu jest małe, co zwiększa ryzyko BPD, gdyż jest ona konieczna dla prawidłowego rozwoju płuc. Prawidłowe stężenie w surowicy noworodka powinno wynosić 200 µg/l (0,70 µmol/l). Proponuje się, aby u dzieci z ELBW suplementacja witaminy A wynosiła 5000 IU domięśniowo trzy razy w tygodniu przez 4 tygodnie.18