Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
- wzrost aktywności enzymów mięśniowych w surowicy – CK, AspAT, AlAT, LDH, aldolazy (prawidłowa aktywność nie wyklucza PM/DM), wzrost stężenia mioglobiny, wzrost OB, wzrost stężenia CRP i gammaglobulin w surowicy
- autoprzeciwciała ANA (u 40-80%), w tym przeciwciała skojarzone z PM/DM (przeciwko syntetazom aminoacylo-tRNA [najczęściej anty-Jo-1], anty-SRP i anty-Mi-2) oraz przeciwciała towarzyszące (anty-Ro, anty-La, anty-U1-RNP, anty-U2-RNP, anty-Ku, anty-Sm, anty-PM/Scl).
Elektromiografia pozwala ujawnić zaburzenia przewodnictwa nerwowo-mięśniowego charakterystyczne dla pierwotnego uszkodzenia mięśni.
Zmiany w badaniach obrazowych:
- obrazowanie metodą rezonansu magnetycznego (MR) mięśni – wzmożenie sygnału w obrazach T1- i T2-zależnych, najczulsze w wykrywaniu aktywnego zapalenia są obrazy T2-zależne z supresją tkanki tłuszczowej lub sekwencje STIR, ale zmiany nie są patognomoniczne dla PM/DM; badanie może ułatwić wybór optymalnego miejsca do pobrania wycinka mięśniowego
- RTG i tomografia komputerowa wysokiej rozdzielczości (TKWR) klatki piersiowej – zmiany śródmiąższowe
- RTG kości i stawów – może ujawnić liczne zwapnienia, głównie w tkance podskórnej i mięśniach, oraz osteoporozę
- EKG – zwykle nieswoiste zmiany odcinka ST i załamka T, tachykardia zatokowa, rzadziej blok AV I° lub II°.
Zmiany w badaniach histologicznych:
- wycinek mięśniowy – naciek zapalny głównie z limfocytów; rodzaj komórek i struktury objęte zapaleniem oraz występowanie zaniku okołopęczkowego zależą od postaci choroby
- wycinek płuca (biopsja chirurgiczna) – może ujawnić śródmiąższową chorobę płuc (różne postaci).
Pacjenci ze skórnymi objawami patognomonicznymi (heliotropowy rumień powiek lub grudki Gottrona, lub objaw Gottrona) nie wymagają rutynowego badania histopatologicznego do ustalenia rozpoznania wg klasyfikacji European League Against Rheumatism/American College of Rheumatology (EULAR/ACR). Dla chorych bez typowych objawów skórnych rekomendowana jest biopsja mięśni. U pacjentów z zapaleniem skórno-mięśniowym bez zajęcia mięśni wykonuje się biopsję wycinka skóry. Biopsja mięśni jest szczególnie ważna w IBM, gdyż ujawnia charakterystyczne dla tej jednostki chorobowej zmiany w komórce mięśniowej: wakuole z ziarnistościami i wtręty kwasochłonne.
Kryteria rozpoznania zapalenia wielomięśniowego
Rozpoznanie zapalenia wielomięśniowego ustala się przede wszystkim na podstawie objawów klinicznych, szczególnie osłabienia mięśni o typowej lokalizacji i przebiegu w połączeniu z wynikami badania histologicznego mięśni i elektromiografii. Zgodnie z kryteriami diagnostycznymi wg Bohana i Petera rozpoznanie PM jest pewne, gdy spełnione są 4 kryteria; prawdopodobne, gdy 3; możliwe, gdy występują 2 kryteria:
- Symetryczne, narastające osłabienie mięśni pasa barkowego i/lub biodrowego
- Obraz histologiczny typowy dla zapalenia mięśni
- Zwiększona aktywność CK lub aldolazy w surowicy
- Cechy pierwotnego uszkodzenia mięśni w elektromiografii.
W 2013 r. opublikowano zmodyfikowane kryteria, które obejmują również punkt 5 – zmiany w MR odpowiadające zapaleniu mięśni.

Tabela 1. Kryteria klasyfikacyjne European League Against Rheumatism/American College of Rheumatology (EULAR/ACR) 2017 postaci dorosłych i młodzieńczych idiopatycznych miopatii zapalnych (IIM) oraz ich głównych podgrup
W 2017 r. EULAR/ACR opublikowały nowe kryteria klasyfikacyjne postaci dorosłych i młodzieńczych idiopatycznych miopatii zapalnych (IIM – idiopathic inflammatory myopathy) oraz ich głównych podgrup (tab. 1).
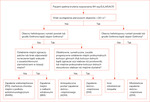
W przypadku spełnienia kryteriów rozpoznania idiopatycznego zapalenia mieśni wg EULAR/ACR w celu ustalenia szczegółowego rozpoznania można się następnie posłużyć schematem diagnostycznym przedstawionym na rycinie 1.
Leczenie zapalenia wielomięśniowego i rokowanie
Mimo działań niepożądanych glikokortykosteroidy (GKS) stanowią pierwszą linię leczenia. Zwykle podaje się prednizolon doustnie w dawce 0,5-1,0 mg/kg/24 h. W razie ciężkiego i ostrego przebiegu można zastosować początkowe pulsy z metyloprednizolonu dożylnie w dawce 250-1000 mg/24 h przez 3-5 dni. W przypadku braku poprawy lub gwałtownego przebiegu stosuje się leki immunosupresyjne, takie jak metotreksat, azatiopryna, cyklofosfamid, cyklosporyna, mykofenolan mofetylu czy pochodne chinoliny. W badaniach kohortowych nie wykazano większej skuteczności któregoś z tych leków. Zwykle jako pierwsze stosuje się metotreksat, azatioprynę lub mykofenolan mofetylu. Ostatnią linią leczenia są dożylne preparaty immunoglobulin (IVIG – intravenous immunoglobulin) oraz leczenie biologiczne rytuksymabem i abataceptem czy tofacytynibem. W przypadkach opornych skuteczne może być też połączenie glikokortykosteroidów z kilkoma lekami immunosupresujnymi, które także pozwalają zredukować dawkę stosowanych GKS, minimalizując tym samym ich działania niepożądane.
Podczas monitorowania pacjentów z zapaleniem wielomięśniowym i zapaleniem skórno-mięśniowym szczególnie ważna jest czujność onkologiczna ze względu na zwiększone ryzyko wystąpienia nowotworów złośliwych. Jest ono największe w ciągu pierwszych 3 lat od rozpoznania PM/DM. Ponad 80% chorych przeżywa 10 lat przy prawidłowo zastosowanym leczeniu.