Kwalifikacja do przeszczepienia wątroby dzieci z ostrą niewydolnością narządu wymaga stosowania innych kryteriów niż u chorych z przewlekłą niewydolnością wątroby. Zastosowanie znajdują kryteria z King’s College Hospital (tab. 2), według których do transplantacji w trybie nagłym kwalifikuje się pacjentów, którzy spełniają 3 kryteria z 5 podanych (wiek, niekorzystna etiologia, stężenie bilirubiny, czas od wystąpienia żółtaczki do encefalopatii, czas protrombinowy) lub którzy spełniają jedyne kryterium, jakim jest czas protrombinowy >100 s7. Inne, specyficzne kryteria stosuje się w przypadku niektórych przyczyn ostrego uszkodzenia wątroby, takich jak zatrucie paracetamolem (tab. 3) oraz choroba Wilsona. Mimo że klasyczne kryteria stosowane są z powodzeniem u dzieci, to według Mieli-Vergani w grupie najmłodszych pacjentów (poniżej 2 lat) model prognostyczny powinien obejmować inne parametry, takie jak: wiek dziecka, INR, stężenie bilirubiny i liczba leukocytów we krwi. Stwierdzenie co najmniej 2 kryteriów spośród wymienionych stanowi wskazanie do przeszczepienia wątroby8 (tab. 4).
Techniki operacji
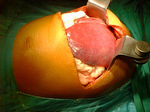
Rycina 1. Obraz śródoperacyjny po przeszczepieniu II i III segmentu wątroby od dawcy żywego spokrewnionego
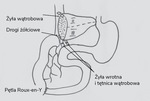
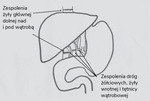
Przeszczepienie wątroby może się odbyć z użyciem całego narządu lub z wykorzystaniem technik wariantowych polegających na redukcji narządu do: lewego płata wątroby (segmenty II, III i IV), prawego płata wątroby (segmenty V, VI, VII, VIII), lewych bocznych segmentów wątroby (segmenty II + III) lub pojedynczego segmentu (III). Techniki wariantowe przeszczepiania wątroby są stosowane w sytuacjach, gdy masa ciała dawcy przekracza dwukrotnie masę ciała biorcy, i wykorzystywane u blisko 50% pacjentów pediatrycznych. Dzielona może być cała wątroba od dawcy zmarłego (SPLIT lub redukcja) bądź można pobrać fragment wątroby od dawcy żywego spokrewnionego. Zespolenia naczyniowe wykonywane są między odpowiednimi naczyniami. Zespolenie żółciowe polega na połączeniu bezpośrednio przewodu wątrobowego dawcy z przewodem żółciowym biorcy sposobem koniec do końca. U dzieci często zachodzi konieczność wykonania zespolenia dróg żółciowych przeszczepu do boku pętli Roux-en-Y z jelita czczego – wynika to z choroby prowadzącej do niewydolności (takiej jak np. wrodzona niedrożność dróg żółciowych) bądź rozmiarów dróg żółciowych przeszczepianego narządu lub dziecka (ryc. 1-3).
Immunosupresja
Leczenie immunosupresyjne jest podstawowym czynnikiem wpływającym na odległe przeżycie przeszczepionego narządu oraz pacjenta. Wątroba jest narządem uprzywilejowanym immunologicznie, co umożliwia stosowanie mniejszych dawek leków immunosupresyjnych niż w przypadku innych narządów, a jej przeszczepienie wywiera protekcyjne działanie immunologiczne na drugi narząd przy transplantacjach wielonarządowych.
Długi przewidywany czas leczenia immunosupresyjnego dzieci po przeszczepieniu wątroby (potencjalnie kilkadziesiąt lat) naraża pacjentów na ryzyko wystąpienia wielu powikłań tej terapii4,9. Podstawowymi lekami immunosupresyjnymi stosowanymi u dzieci po przeszczepieniu wątroby są inhibitory kalcyneuryny, głównie takrolimus (TAC; stosowany u ponad 90% biorców), oraz cyklosporyna (Cs). Razem z inhibitorem kalcyneuryny w pierwszym okresie po transplantacji podaje się często antymetabolity (mykofenolan mofetylu [MMF], rzadziej azatioprynę) oraz glikokortykosteroidy (GKS). Stosowane są one najczęściej w połączeniach: TAC + GKS lub TAC + MMF albo TAC + MMF + GKS.
Takrolimus podaje się w dawce 0,05-0,1 mg/kg co 12 godz. Wymagane jest monitorowanie stężenia leku we krwi (tzw. stężenia na czczo, tj. przed podaniem kolejnej dawki). Wymagane stężenie leku zależy od stosowanego schematu immunosupresji, choroby podstawowej oraz czasu od przeszczepienia narządu. Skutki uboczne przyjmowania inhibitorów kalcyneuryny to: nefrotoksyczność, nadciśnienie tętnicze, zaburzenia gospodarki lipidowej, cukrzyca, neurotoksyczność, wypadanie włosów i łysienie plackowate (TAC), przerost dziąseł i hirsutyzm (Cs).
Mykofenolan mofetylu, będący pochodną kwasu mykofenolowego, jest często stosowany w zestawieniu z inhibitorami kalcyneuryny w podstawowych schematach immunosupresji w profilaktyce odrzucania przeszczepu. Dzięki temu możliwe jest zmniejszenie dawki inhibitorów kalcyneuryny i osłabienie ich działania nefrotoksycznego. Głównymi działaniami niepożądanymi terapii MMF są zaburzenia żołądkowo-jelitowe oraz supresja szpiku (leukopenia i małopłytkowość). Leki te wykazują też potencjalne działanie teratogenne.
Glikokortykosteroidy stosowane są w indukcji immunosupresji, leczeniu podtrzymującym oraz leczeniu ostrego odrzucania. W ostatnich latach obserwuje się tendencję do ograniczania stosowania GKS u dzieci ze względu na ich liczne działania niepożądane. Przeciwwskazaniami do odstawienia GKS są: kolejne przeszczepienie, epizod wystąpienia ostrego odrzucania, obecność przeciwciał przeciw antygenom dawcy, choroby autoimmunologiczne, przeszczepienie niezgodne w układzie głównych grup krwi AB0. Do skutków ubocznych GKS zalicza się m.in.: nadciśnienie tętnicze, upośledzenie tolerancji glukozy lub cukrzycę, hipokaliemię, przyrost masy ciała, rozstępy i trądzik, osłabienie siły mięśni, zapalenie błony śluzowej żołądka lub wrzody żołądka, zaburzenia emocjonalne (depresję, chwiejność emocjonalną, upośledzenie czynności poznawczych, zaburzenia snu), osteoporozę i zaćmę.
W części ośrodków stosuje się tzw. immunosupresję sekwencyjną z wykorzystaniem indukcji immunosupresji bazyliksymabem (monoklonalne przeciwciała anty-CD25, przeciw receptorowi dla interleukiny 2) rutynowo lub w szczególnych wskazaniach (np. w indukcji leczenia immunosupresyjnego u biorców z niezgodną grupą krwi w układzie AB0 z dawcą narządu, z dużym ryzykiem immunologicznym lub w celu opóźnienia wprowadzenia inhibitorów kalcyneuryny u pacjentów z niewydolnością nerek).
Przeciwciała poliklonalne w postaci surowicy antytymocytarnej (ATG – anti-tymocyte globulins) są obecnie rzadko wykorzystywane w indukcji immunosupresji, znajdują natomiast zastosowanie w leczeniu ostrego odrzucania opornego na steroidy. Objawy uboczne są związane z silną immunosupresją i mają głównie charakter infekcyjny oraz ze zwiększonym ryzykiem rozwoju potransplantacyjnej choroby limfoproliferacyjnej (PTLD – post-transplant lymphoproliferative disorder).
Leczenie immunosupresyjne u dzieci wymaga indywidualizacji w przypadku:
- przeszczepień przy niezgodnych grupach krwi w układzie AB0 między dawcą a biorcą wątroby
- chorób autoimmunologicznych jako wskazań do przeszczepienia
- przeszczepień wątroby wraz z innym narządem (np. nerką lub jelitem)
- przeszczepień ze wskazań nowotworowych
- gdy biorca wątroby jest w fazie niewydolności nerek.
Ze względu na liczne skutki uboczne leczenia GKS rekomenduje się ograniczenie ich stosowania u dzieci poprzez kontynuację immunosupresji bez steroidów lub też podawanie ich tak krótko, jak tylko możliwe, w zależności od indywidualnych wskazań. Zaleca się u dzieci w miarę możliwości również minimalizację immunosupresji poprzez przejście na monoterapię TAC oraz możliwie wczesne obniżenie zalecanego stężenia podstawowego leku immunosupresyjnego. U wyselekcjonowanej grupy biorców, którzy uzyskali tzw. operacyjną tolerancję, istnieje możliwość całkowitego odstawienia leków immunosupresyjnych po kilku latach od transplantacji.
Należy pamiętać o możliwych interakcjach leków immunosupresyjnych z wieloma innymi preparatami, które mogą być podawane biorcy po przeszczepieniu. Mogą one istotnie wpływać na stężenie leków immunosupresyjnych i w przypadku jego podwyższenia powodować nasilenie ich skutków ubocznych lub w przypadku jego obniżenia narażać na odrzucanie przeszczepu.
Powikłania po przeszczepieniu wątroby
Pierwotny brak czynności przeszczepionego narządu (PNF – primary nonfunction) zdarza się bardzo rzadko (<1%). Czynnikami ryzyka są: zaawansowane stłuszczenie wątroby dawcy, długi czas od pobrania do reperfuzji narządu u biorcy, pobranie narządu od tzw. dawcy marginalnego. Objawami PNF są: zwiększona aktywność transaminaz, głębokie zaburzenia krzepnięcia, hipoglikemia, niewydolność wielonarządowa. Leczenie polega na natychmiastowej ponownej transplantacji.