Od teorii do praktyki
Atopowe zapalenie skóry (cz. 1). Dylematy teoretyczne
Prof. dr hab. med. Magdalena Czarnecka-Operacz
Dr hab. med. Dorota Jenerowicz
Atopowe zapalenie skóry (AZS) jest najczęstszą przewlekłą chorobą zapalną skóry. U chorych na AZS objawy kliniczne często wyprzedzają rozwój astmy i alergii na pokarmy. Ostatnie badania koncentrujące się na etiopatogenezie AZS wykazały zaburzenia w procesie końcowego różnicowania komórek naskórka, co stanowi podstawę do rozwoju dysfunkcji strukturalnej oraz funkcjonalnej warstwy rogowej naskórka. Prowadzi to z kolei do ułatwionej penetracji alergenów środowiskowych w głąb naskórka i rozwoju układowego uczulenia IgE-zależnego.
Skóra chorego na AZS wykazuje też wyraźną predyspozycję do kolonizacji lub nadkażeń bakteryjnych, ze szczególnym udziałem patogennego mikroba, jakim jest Staphylococcus aureus oraz herpes simplex virus.
Przyczyny zaburzeń w zakresie bariery skórnej są bardzo złożone i obejmują zarówno czynniki genetyczne, środowiskowe, jak i czynniki immunologiczne. Właśnie ta złożoność rozmaitych czynników warunkujących zaburzenia bariery skórnej odpowiada za kliniczną heterogenność AZS w zakresie czasu pojawienia się pierwszych objawów, ciężkości przebiegu i naturalnej historii choroby.
Niedawno opublikowane wyniki badań wykazały, że wczesna profilaktyka emolientowa może stanowić ochronę bariery skórnej. Już pierwsze, aktywne zmiany skórne wymagają zarówno leczenia miejscowego, jak i aktywacji układu odpornościowego na drodze ogólnej. Dobór odpowiedniej strategii terapeutycznej jest w tym schorzeniu kluczowy. Wczesna interwencja może poprawiać długoterminowe wyniki stosowanego leczenia AZS i ograniczać rozwój ogólnego uczulenia IgE-zależnego, które może być następnie związane z pojawieniem się alergicznych chorób w zakresie układu pokarmowego oraz oddechowego.
Atopowe zapalenie skóry (AZS) jest najczęściej rozpoznawaną, przewlekłą, zapalną chorobą skóry.[1,2] Ostatnio wykazano silny związek pomiędzy występowaniem różnorodnych schorzeń o podłożu zaburzeń psychicznych a rozwojem objawów klinicznych AZS, co wyraźnie wskazuje na konieczność uwzględnienia szeroko pojętej psychoterapii w planowaniu indywidualnie dobranej konstrukcji działań terapeutycznych zarówno w odniesieniu do samego pacjenta, jak i jego rodziny.[3] U chorych na AZS obserwuje się też rozwój uczulenia w zakresie pokarmów oraz klinicznych objawów astmy.[4,5] Wydaje się, że nieprawidłowa struktura i funkcja bariery naskórkowej u chorych na AZS warunkuje ułatwioną penetrację alergenów środowiskowych przez warstwę rogową naskórka i w ten sposób dochodzić może do rozwoju uczulenia IgE-zależnego w odniesieniu do alergenów pokarmowych i powietrznopochodnych (alergia na pokarmy, astma oskrzelowa). Ponieważ obecnie nie dysponujemy możliwościami wyleczenia pacjenta z alergii pokarmowej czy astmy, jak najdokładniejsze wyjaśnienie mechanizmów leżących u podstaw rozwoju AZS wydaje się niezwykle istotnym elementem w zakresie tzw. wczesnej interwencji.
AZS jest złożoną chorobą o silnie wyrażonym podłożu genetycznym wpływającym na charakterystykę pierwotnej i nabytej odpowiedzi immunologicznej. Poza tym niezwykle istotną rolę odgrywają różnorodne czynniki środowiskowe, takie jak:
- ekspozycja na alergeny,
- czynniki drażniące,
- drobnoustroje,
- dieta,
- stres,
- zanieczyszczenia powietrza.[6-10]
Dotychczas AZS postrzegane było jako dermatoza o relatywnie jednorodnej charakterystyce, ale w świetle ostatnich badań należy stwierdzić, że istnieje konieczność rozróżnienia odmiennych fenotypów i endotypów AZS (tabela 1)[11,12] w podobny sposób, w jaki dokonano tego w przypadku astmy oraz rhinosinusitis. Wyodrębniono bowiem podgrupy w oparciu o takie elementy jak:
- charakterystyka rozwoju pierwszych objawów klinicznych,
- biomarkery,
- polaryzacja immunologiczna,
- warianty genowe,
- naturalny przebieg choroby.[13-15]
Wydaje się, że szczególnie istotne jest określenie poszczególnych ścieżek polaryzacji immunologicznej ze względu na to, że znamy leki biologiczne o działaniu ściśle ukierunkowanym na poszczególne ścieżki immunologiczne, takie jak ścieżka Th2 i Th22, oraz leki działające na wybrane cytokiny i mediatory biorące udział w rozwoju stanu zapalnego skóry.[16,17] W niniejszym artykule przedstawimy dylematy dotyczące etiopatogenezy atopowego zapalenia skóry, z uwzględnieniem genetycznie uwarunkowanych oraz nabytych przyczyn zaburzeń struktury i funkcji bariery naskórkowej, które odpowiedzialne są za całą naturalną historię przebiegu choroby.[18-20] Przedstawimy też dylematy kliniczne, w tym trudności w rozpoznawaniu poszczególnych fenotypów AZS, oraz dylematy terapeutyczne, w świetle możliwości działania profilaktycznego, wczesnej interwencji oraz nowoczesnej terapii indywidualnie dobieranej dla konkretnego pacjenta.
Dylematy etiopatogenetyczne
Zaburzenia w zakresie bariery naskórkowej u chorych na AZS (ryc. 1)
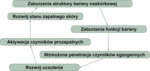
Ryc. 1. Zamknięte koło wzajemnych zależności pomiędzy barierą naskórkową i układem immunologicznym w atopowym zapaleniu skóry.
Najwięcej uwagi dotychczas poświęcono wielokierunkowej roli filagryny (FLG) w funkcjonowaniu bariery naskórkowej u chorych na AZS.[21,22] W przypadku pacjentów, u których stwierdza się mutacje genów filagrynowych (AZS FLG), zarówno obraz kliniczny, jak i przebieg schorzenia jest odmienny w porównaniu z chorymi bez wspomnianych mutacji (AZS non-FLG). W przypadku chorych na AZS FLG nasilenie suchości skóry jest zdecydowanie bardziej zaznaczone, pierwsze objawy chorobowe występują wcześniej, sam przebieg jest bardziej przewlekły i często pojawiają się kliniczne objawy astmy, alergii na pokarmy oraz zakażeń bakteryjnych skóry.[23-25] Na podstawie obecnej wiedzy wydaje się, że wspomniane dwa typy AZS charakteryzują się odmiennymi ścieżkami rozwoju stanu zapalnego skóry.[26] W pierwszym typie rejestruje się wzmożoną ekspresję IL-1 w obrębie warstwy rogowej naskórka oraz mediowany przez interferon typ 1 odpowiedzi na stres.[27,28] Z kolei w przypadku dzieci należących do drugiego typu (AZS non-FLG) obserwuje się zaburzenia procesów metabolizmu lipidów.[28] Wiadomo też, że zależne od filagryny uwalnianie sfingomielinazy wydaje się pełnić rolę ochronną w zakresie śmierci komórkowej indukowanej przez gronkowcową α-toksynę.[29] Obserwacje te wskazują jednoznacznie, że pacjenci wykazujący mutacje filagrynowe stanowią odmienny endotyp AZS, o zdecydowanie innym przebiegu klinicznym i możliwość ich identyfikacji mogłaby stanowić podstawy do rozwoju i wdrożenia celowanych terapii ukierunkowanych na poprawę struktury i funkcji bariery naskórkowej w tej właśnie grupie chorych.
Jak wiadomo, kliniczna manifestacja AZS uwarunkowana jest złożonymi interakcjami pomiędzy genetyką i środowiskiem oraz pomiędzy poszczególnymi genami. Genowo-środowiskowe interakcje udokumentowano badaniami na modelach mysich, które pozbawione genów filagrynowych po ekspozycji ich skóry na alergeny środowiskowe lub mikroorganizmy rozwijały objawy wyprysku.[30] Na tej samej zasadzie we wspomnianej grupie pacjentów (AZS FLG) wczesna ekspozycja na alergeny roztoczowe może prowadzić do rozwoju uczulenia na alergeny roztoczowe.[31-33]
W odniesieniu do interakcji pomiędzy poszczególnymi genami w badaniach na modelach mysich (flaky tail mice) wykazano możliwość spontanicznego rozwoju klinicznych objawów AZS w sterylnych warunkach wolnych od wszelkich mikroorganizmów środowiskowych.[34,35]
W zależności od analizowanej populacji chorych na AZS mutacje FLG stwierdza się u do 40 proc. chorych o ciężkim przebiegu choroby, ale mniej niż 20 proc. w tej grupie pacjentów jest homozygotami lub złożonymi heterozygotami w odniesieniu do mutacji FLG.[36] Co więcej, mutacje FLG stwierdza się jedynie w przypadku zdecydowanej mniejszości populacji euroamerykańskiej i praktycznie nie rejestruje się ich u afroamerykańskich chorych na AZS.[21,22,37,38]
Wiadomo też, że istnieje wiele zróżnicowanych przyczyn ograniczających ekspresję FLG w skórze. Najczęstszą z nich jest aktywacja układu immunologicznego.[39-41] Należy jednak zdecydowanie podkreślić epigenetyczną drogę prowadzącą do tego samego efektu w odniesieniu do ekspresji FLG.[42]


