Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 23:59! Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Radioterapia chorych na raka szyjki macicy: zastosowanie, możliwości i ograniczenia
Bogusław Lindner
Wstęp
Historia radioterapii chorych na raka szyjki macicy sięga pierwszej dekady XX wieku, kiedy to po odkryciu promieniotwórczych właściwości radu przez małżonków Curie wykorzystano go w leczeniu nowotworów. Stosowano sole radu, posługując się różnymi technikami aplikacji do szyjki i jamy macicy. Metoda bezpośredniego napromieniania śródtkankowego i śródjamowego nowotworu, nazwana brachyterapią (curieterapią), stosowana jest współcześnie w zmodyfikowanej i zaawansowanej technologicznie postaci. Odkrycia Roentgena i Becquerela otworzyły drogę do rozwoju teleradioterapii, czyli napromieniania tkanki guza nowotworowego z pewnej odległości. Początkowo wykorzystano naturalne źródła promieniowania gamma radu w postaci tzw. bomb radowych, następnie wraz z rozwojem nauki w radioterapii znalazły zastosowanie inne naturalne źródła promieniowania, głównie kobalt (60Co).
W radioterapii chorych na raka szyjki macicy, w zależności od sytuacji klinicznej, można stosować brachyterapię (wewnątrzmaciczną i/lub dopochwową), napromienianie wiązkami zewnętrznymi lub skojarzenie tych dwu metod.
Teleradioterapia
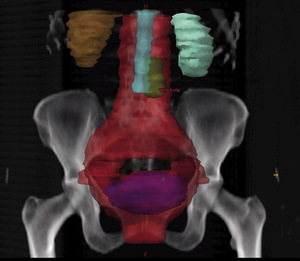
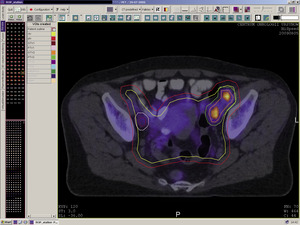
Rycina 1. Trójwymiarowa rekonstrukcja wyznaczonych objętości do napromieniania i wybranych narządów krytycznych w planowaniu radioterapii 3D chorej na raka szyjki macicy.
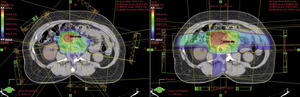
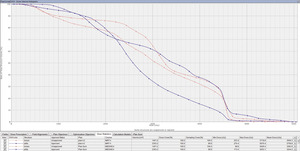
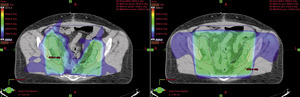
Teleradioterapia, napromienianie wiązkami zewnętrznymi, jest prowadzona głównie przy użyciu wysokoenergetycznych fotonów X, generowanych w przyspieszaczach liniowych. W wybranych sytuacjach mają też zastosowanie wiązki elektronów o różnie dobieranych energiach. Coraz rzadziej stosowane jest promieniowanie gamma kobaltu 60. Postęp technologiczny i dostępność komputerowych systemów planowania przestrzennego radioterapii, opartych na nowoczesnych technikach obrazowania, umożliwiły w większości ośrodków planowanie radioterapii dostosowawczej (konformalnej), realizowanej według indywidualnie przygotowanych planów leczenia. Planowanie pól napromieniania odbywa się przestrzennie – trójwymiarowo (3D), z wykorzystaniem przekrojów tomografii komputerowej, na których lekarz oznacza guz nowotworowy, elektywny obszar do napromienienia (regionalne węzły chłonne z adekwatnym marginesem) i narządy krytyczne (ryc. 1). W wybranych przypadkach w planowaniu wykorzystuje się połączenia obrazów z badaniem pozytonową tomografią emisyjną (PET-TK), co daje możliwość zwiększenia dawki w obszarze dużej aktywności metabolicznej guza nowotworowego lub jego przerzutów do regionalnych węzłów chłonnych (ryc. 2).1,2 Za pomocą komputerowych systemów planowania leczenia fizyk tworzy indywidualny plan leczenia, który powinien spełniać kryteria jednorodnego rozkładu dawki promieniowania w planowanej objętości napromienianej (PTV) oraz dużego gradientu dawki poza tą objętością. Jednocześnie nie należy przekraczać ustalonych dawek tolerancji w narządach krytycznych (OR) (ryc. 3). Dopasowanie kształtu pola napromieniania do konturu planowanej objętości napromienianej osiąga się, stosując kolimatory wielolistkowe o zmiennym kształcie. Poprawność planowania radioterapii oparta na kryteriach zebranych w raportach 50 i 62 International Commission on Radiation Units (ICRU) dokumentują histogramy rozkładu dawki promieniowania w planowanej objętości i w wybranych narządach krytycznych (ryc. 4). Ośrodki wyposażone w nowoczesne wysokoenergetyczne przyspieszacze liniowe i wysoko wydajne systemy planowania radioterapii mogą stosować radioterapię z użyciem modulacji intensywności dawki promieniowania (intensity modulated radiation therapy, IMRT). Główną zaletą tej techniki jest możliwość modelowania dawki całkowitej promieniowania w obszarze napromienianym z oszczędzeniem struktur krytycznych (ryc. 5).3 Technika dwuwymiarowa (2D) stosowana jest nadal z powodzeniem w przypadkach leczenia paliatywnego. Stosuje się wówczas najprostsze techniki dwu pól przeciwległych i czteropolową technikę „box”, polegającą na napromienianiu odpowiednio na dwa lub cztery pola wlotowe, których płaszczyzny są parami równolegle. Powyższe napromienianie nie gwarantuje jednak jednorodnego rozkładu dawki promieniowania w wyznaczonej objętości. Stwarza ono też ryzyko przedawkowania ponad należną dawkę promieniowania w obrębie narządów krytycznych.
Brachyterapia
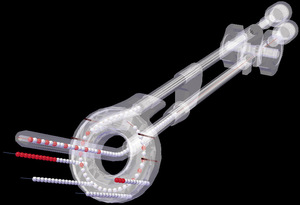
Rycina 6. Schemat aplikatora pierścieniowego (ring) do brachyterapii źródłem o wysokiej mocy dawki promieniowania (HDR).
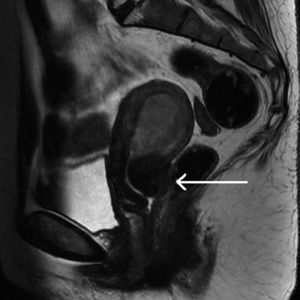
Rycina 7. Obraz raka szyjki macicy naciekającego odbytnicę uzyskany w badaniu rezonansu magnetycznego (MR).