Zasady kontroli ambulatoryjnej i terapii chorego ze wszczepionym systemem wspomagania lewokomorowego
W trakcie hospitalizacji związanej ze wszczepieniem urządzenia do wspomagania lewokomorowego niezbędne jest przeszkolenie chorego oraz – jeśli to jest możliwe – bliskich zamieszkujących z nim w zakresie obsługi pompy, tj. zasad wymiany baterii, obsługi i umiejętności awaryjnej wymiany części kontrolnej, właściwej reakcji na alarmy sygnalizowane przez urządzenie, zasad kontaktu z ośrodkiem leczącym oraz reagowania na zdarzenia niepożądane i alarmy oraz raportowania ich. Chory uczy się obsługi urządzenia do domowego oznaczania INR i sterylnej wymiany opatrunku w okolicy wyjścia kabla części kontrolnej. Pacjent pozostaje pod opieką kardiologiczna i kardiochirurgiczną ośrodka, w którym dokonano wszczepienia LVAD. W Instytucie Kardiologii w Warszawie chorych szkoli się też w obsłudze internetowej systemu zdalnego monitorowania parametrów klinicznych służącego do stałej oceny ich stanu (system Remedizer) i kontaktu telefonicznego w przypadku stwierdzenia nieprawidłowości. W innych ośrodkach jest to realizowane przez stałe kontakty telefoniczne pacjenta z personelem medycznym ośrodka.
Zasady terapii
Niezbędne jest podawanie warfaryny w dawce zapewniającej utrzymanie INR w granicach 2-3, zazwyczaj w skojarzeniu z kwasem acetylosalicylowym w dawce 75-150 mg. Ponadto chory otrzymuje typowe leki stosowane w terapii niewydolności serca w dawkach dostosowywanych do sytuacji klinicznej.
Specyfika ciągłego przepływu krwi powoduje, że w przypadku braku otwarcia zastawki aortalnej pomiar klasyczną metodą Korotkowa jest niemożliwy; konieczne jest wtedy zastosowanie pomiaru z wykorzystaniem badania dopplerowskiego. W praktyce jednak wśród chorych monitorowanych w naszym ośrodku u ponad 80% istnieje możliwość pomiaru metodą klasyczną. Zaleca się utrzymywanie wartości średniego ciśnienia tętniczego ≤80 mmHg lub <130/85 przy przepływie pulsacyjnym za pomocą leków hipotensyjnych, jeśli jest to niezbędne.4 W trakcie zdalnego monitorowania kontrolowane są: samopoczucie chorego, występowanie stanów gorączkowych, wartość INR, wyniki pomiarów ciśnienia krwi, pojawianie się ewentualnych alarmów, zmian zużywanej mocy systemu wspomagania odczytywanej z części kontrolnej.
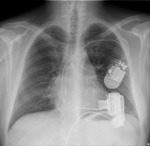
Rycina 5. Zdjęcie RTG P-A chorego z implantowanym systemem HeartMate 3™. Dzięki uprzejmości Zakładu Radiologii Instytutu Kardiologii w Warszawie
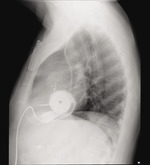
Rycina 6. Zdjęcie RTG w projekcji bocznej chorego z implantowanym systemem HeartMate 3™. Dzięki uprzejmości Zakładu Radiologii Instytutu Kardiologii w Warszawie
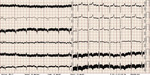
Rycina 7. Przykładowy elektrokardiogram chorego ze wspomaganiem mechanicznym – charakterystyczne artefakty elektryczne często spotykane u chorych z pompami wspomagającymi lewą komorę
W trakcie planowych okresowych wizyt kontrolnych w ośrodku dokonuje się kontroli samego urządzenia z odczytaniem historii alarmów, uzupełnionej badaniami echokardiograficznym, elektrokardiograficznym i okresowo radiologicznym (ryc. 5 i 6). Rutynowo wykonywane są badania krwi, morfologii, INR, liczby płytek, biochemiczne z uwzględnieniem funkcji nerek, bilirubiny, jonogramu oraz dodatkowo dehydrogenazy mleczanowej (LDH). Oceniana jest okolica wyjścia ze skóry kabla części kontrolnej z pobraniem posiewów w przypadku podejrzenia infekcji.
Podstawowym obrazowym badaniem kontrolnym jest echokardiografia. Mimo artefaktów wywołanych przez pompę z kaniulą doprowadzającą możliwe jest zwykle uwidocznienie przepływu w okolicy kaniuli doprowadzającej, wielkości jam serca, stopnia otwarcia zastawki aortalnej w skurczu oraz ewentualnej jej niedomykalności, a także kierunku wychylenia przegrody międzykomorowej, co wskazuje na stopień odciążenia lewej i/lub przeciążenia prawej komory.
Sygnałem alarmowym mogącym wskazywać na ryzyko zakrzepicy w obrębie systemu wspomagania jest wzrost mocy pobieranej przez urządzenie, szczególnie jeśli towarzyszy temu niewyjaśnione zwiększenie aktywności LDH. W przypadku podejrzenia zakrzepicy przydatna dla jej lokalizacji może być naczyniowa tomografia komputerowa.
W badaniu elektrokardiograficznym w kilku odprowadzeniach mogą występować pochodzące z pompy trudne do wyeliminowania zakłócenia elektryczne (ryc. 7).
Najczęstszymi alarmami urządzenia zgłaszanymi przez chorych są alarmy niskiego przepływu – z reguły ich przyczyną jest nadmierne odwodnienie chorego (niewystarczające przyjmowanie płynów, nadmiar diuretyków). Doraźne leczenie polega na uzupełnieniu płynów doustnie lub dożylnie, wyższym ułożeniu nóg.
W przypadku stanów naglących i konieczności pilnego leczenia, np. chirurgicznego, postępowanie nie odbiega od typowych zasad stosowanych w leczeniu przeciwkrzepliwym. Ostrożności wymaga prowadzenie linii cięcia chirurgicznego blisko i powyżej punktu wyjścia kabla części kontrolnej. Zalecana jest profilaktyka antybiotykowa zgodnie z zasadami stosowanymi u chorych z implantowanymi zastawkami mechanicznymi serca.
W przypadku konieczności reanimacji szczególnej ostrożności wymaga stosowanie mechanicznego ucisku mostka ze względu na możliwość uszkodzenia serca przez sztywne elementy urządzenia.
Szczegółowe przedstawienie zasad opieki nad chorym ze wszczepionym systemem wspomagania lewokomorowego przekracza zakres tego opracowania.
Kierunki dalszego rozwoju mechanicznego wspomagania serca
W ostatnich latach dokonał się ogromny postęp w zakresie szerszego zastosowania systemów długoterminowego wspomagania pracy lewej komory serca. Doskonalenie parametrów technicznych i niezawodności urządzeń spowodowało, że trwa dyskusja nad rozszerzeniem grupy chorych objętych tą formą leczenia o chorych z mniej zaawansowanymi, tzw. ambulatoryjnymi objawami (klasa INTERMACS od 4 do 6). W rejestrach liczba chorych w klasie INTERMACS 4-7 zmniejszyła się jednak z około 18% w latach 2012-2014 do 13% w latach 2015-2016. Ostatnio opublikowane wyniki 2-letniej obserwacji nierandomizowanego obserwacyjnego badania ROADMAP5 wskazują, że to rozszerzenie wskazań i wcześniejsze wszczepienie LVAD (HeartMate II™) poprawia jakość życia chorych, nie powodując zwiększenia umieralności ani liczby zdarzeń niepożądanych w porównaniu z grupą chorych leczonych farmakologicznie. Mimo możliwych zastrzeżeń co do tego, że nie było to badanie randomizowane,6 jego efekty wskazują na możliwy kierunek rozwoju tej metody leczenia. Aby z pełnym przekonaniem kierować chorych w tym wcześniejszym okresie niewydolności serca na leczenie LVAD, konieczna jest moim zdaniem dalsza redukcja zdarzeń niepożądanych, szczególnie udarów mózgu, ale również powikłań infekcyjnych w toku obserwacji odległej, tj. w ciągu 3-5 lat od wszczepienia.