Strukturalne choroby serca i kardiomiopatie
Ostre zespoły aortalne
Andrzej Kułach,1 Mariusz Skowerski,1,2 Magdalena Mizia,3 Marek Jasiński,4 Tomasz Urbanek,5 Zbigniew Gąsior1,2
Wprowadzenie
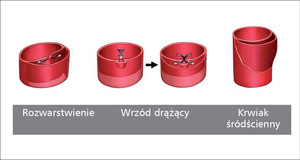
Rycina 1. Podział ostrych zespołów aortalnych.
Nienaber C. A Eur Heart J 2012;33:26-35. Przedrukowano za zgodą.
Ostry zespół aortalny (acute aortic syndrome, AAS) obejmuje grupę chorób, których wspólnym mianownikiem jest ostry przebieg kliniczny, potencjalnie zagrażający życiu, spowodowany przez patologiczny proces w ścianie aorty polegający na jej rozwarstwieniu, zazwyczaj w obrębie błony środkowej. Pojęcie ostrego zespołu aortalnego zostało wprowadzone na początku ubiegłej dekady [1] i w klasycznej formie obejmuje trzy choroby: rozwarstwienie aorty (aortic dissection, AD), krwiak śródścienny (aortic intramural hematoma, AIH/IMH) oraz wrzód drążący aorty (penetrating aortic ulcer, PAU) (ryc. 1). Mimo patofizjologicznych różnic między tymi chorobami, podobna prezentacja kliniczna (zależna głównie od lokalizacji niż charakteru zmiany), a także wspólna strategia postępowania diagnostycznego i terapeutycznego, uzasadnia wprowadzenie pojęcia AAS do praktyki klinicznej. Ze względu na podobny obraz kliniczny i lokalizację patologii w wielu opracowaniach za postać AAS uznaje się również pęknięcie tętniaka aorty oraz uraz aorty (traumatic aortic rupture, TAR) [2] Pierwsza z tych jednostek wynika z destabilizacji przewlekłej patologii strukturalnej aorty, druga z działania czynników zewnętrznych.
AAS dotyka rocznie 2-3,5 chorych na 100 000 osób, a najczęściej rozpoznawanym typem AAS jest rozwarstwienie aorty [3,4]. IMH odpowiada za 10-30% AAS [5]. PAU jest postacią rozpoznawaną stosunkowo rzadko i dotyczy głównie aorty zstępującej. Warto jednak zaznaczyć, że poszczególne postaci AAS mogą ewoluować i wielokrotnie do ostatecznego rozpoznania dochodzi, gdy pojawią się objawy dyssekcji aorty, którą względnie łatwo zdiagnozować.
Głównym czynnikiem predysponującym do wystąpienia AAS jest nadciśnienie tętnicze, które rozpoznawane jest u 75% chorych z zespołem aortalnym. Nie bez znaczenia pozostają jednak uwarunkowania genetyczne lub ogólnoustrojowy proces zapalny z zajęciem aorty. Szczególnie AAS w młodszej populacji bez wywiadu w kierunku urazu lub zabiegu kardiochirurgicznego rodzi podejrzenie podłoża w postaci patologii wrodzonej lub zapalnej. Genetyczne czynniki ryzyka to przede wszystkim zaburzenia przemiany tkanki łącznej (wynikające głównie z mutacji genów kolagenu, fibryliny, receptora dla TGFβ), jak zespół Marfana, Ehlersa-Danlosa, Loeysa-Dietza [2,6]. Choć zespoły te występują stosunkowo rzadko w populacji ogólnej, częstość występowania poważnych patologii aorty wśród chorych z tymi zaburzeniami przekracza 50%. Dlatego wśród młodej części populacji z tętniakiem lub dyssekcją aorty 20% to chorzy z rozpoznanym genetycznym zaburzeniem metabolizmu tkanki łącznej. Drugą grupą chorób predysponujących do AAS są choroby zapalne zarówno o podłożu infekcyjnym (kiła, gruźlica), jak i autoimmunologicznym (choroba Takayasu, choroba Behçeta, olbrzymiokomórkowe zapalenie naczyń) [7]. Jednak statystycznie typowy chory z ostrym zespołem aortalnym to osoba w wieku około 60 lat z wywiadem w kierunku wieloletniego nadciśnienia tętniczego.
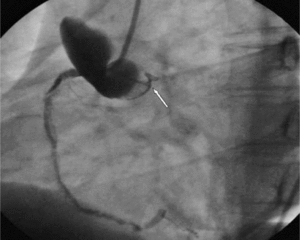
Szczególną grupę chorych stanowią ci z jatrogennym AAS. W populacji tej dominują ostre rozwarstwienia z wrotami dyssekcji w aorcie wstępującej. Najczęstszymi przyczynami jatrogennego AD są zabiegi cewnikowania serca (ryc. 2) oraz operacje na zastawce aortalnej [8]. Innym potencjalnym zagrożeniem jest leczenie kontrapulsacją wewnątrzaortalną. Jatrogenne rozwarstwienie aorty wiąże się z większą śmiertelnością niż niejatrogenne (35 vs 24%) [9], ponieważ częściej obejmuje ujście tętnic wieńcowych lub naczyń dogłowowych, a sama dyssekcja postępuje gwałtownie.
Patofizjologia AAS
Rozwarstwienie aorty
Jak wspomniano, najczęściej rozpoznawaną postacią AAS jest rozwarstwienie aorty (AD) [10]. Pierwotnym zjawiskiem patologicznym w AD jest uszkodzenie i przerwanie ciągłości błony wewnętrznej w miejscu działania wysokich ciśnień, a następnie rozwarstwienie błony środkowej przez krew wpływającą wrotami rozwarstwienia i utworzenie światła rzekomego, postępującego w kierunku dystalnym, ale również proksymalnym w stosunku do lokalizacji wrót. Najważniejszym powikłaniem dyssekcji aorty jest niedokrwienie organów, których naczynia tętnicze odchodzą z odcinka objętego dyssekcją [11]. W tym mechanizmie AD może wywoływać niedokrwienie lub zawał mięśnia sercowego, udar niedokrwienny mózgu, niedokrwienie kończyn, nerek lub jelit. Rozwarstwienie aorty wstępującej objętej workiem osierdziowym stwarza również ryzyko tamponady. Obecność drugiego uszkodzenia błony wewnętrznej (wrót wtórnych) zlokalizowanego dystalnie do wrót pierwotnych pozwala na utrzymanie przepływu krwi również w świetle rzekomym, co paradoksalnie może poprawiać sytuację, ponieważ zmniejsza ucisk światła rzekomego na światło prawdziwe oraz pozwala na przynajmniej częściowe zachowanie przepływu w naczyniach odchodzących w odcinku rozwarstwionym.
Podstawowym czynnikiem rokowniczym w AD jest lokalizacja wrót rozwarstwienia oraz objęcie przez proces rozwarstwienia aorty wstępującej (patrz: Systemy klasyfikacyjne). Objęcie procesem chorobowym aorty wstępującej wiąże się z 20% ryzykiem zgonu w pierwszej dobie oraz 50% ryzykiem w ciągu miesiąca przy braku leczenia chirurgicznego oraz odpowiednio 10 i 20% mimo podjęcia leczenia zabiegowego [12]. W AD nieobejmującym aorty wstępującej 30-dniowa śmiertelność wynosi około 10%, jednak ryzyko znacznie wzrasta, gdy dochodzi do niedokrwienia narządów trzewnych i nerek, co może wymuszać konwersję strategii terapeutycznej do pilnego zabiegu.
Krwiak śródścienny
W porównaniu z AD krwiak śródścienny wiąże się z nieco lepszym rokowaniem, a w niewielkim odsetku z bezobjawowym przebiegiem. IMH zazwyczaj powstaje bez uszkodzenia błony wewnętrznej aorty, a podstawowym patomechanizmem jest krwawienie z naczyń odżywczych aorty (vasa vasorum) do często objętej procesem degeneracji ściany aorty. W powstałej przestrzeni nie jest zachowany przepływ, wobec czego dochodzi do wykrzepiania krwi i powstania krwiaka. Drugim mechanizmem powstania IMH jest powstawanie krwiaka śródściennego przez drążący wrzód aorty [13].
W niewielkim odsetku przypadków (ok. 10%) IMH może ulegać samoistnemu wchłonięciu. W 28-47% dochodzi jednak do progresji do typowego rozwarstwienia poprzez wtórne do IMH pojawienie się uszkodzenia błony wewnętrznej i tym samym wrót rozwarstwienia. Ryzyko pęknięcia IMH szacuje się na 20-45% [14].
Wrzód drążący aorty
Wrzód drążący aorty, w przeciwieństwie do AD i częściowo IMH, jest patologią ściśle związaną z blaszką miażdżycową i procesem degeneracji w jej obrębie. PAU lokalizuje się najczęściej (>90% przypadków) w aorcie zstępującej (co wiąże się z lokalizacją blaszek miażdżycowych) i występuje zwykle u osób starszych [15]. W zależności od głębokości penetracji wrzodu może doprowadzać do powstania IMH, klasycznej dyssekcji (uszkodzenie w obrębie wrzodu stanowi wrota), a przy głębokiej inwazji wrzodu – do pęknięcia aorty, które z PAU występuje z największą częstością (42%) [16].
Poszczególne postacie AAS mimo pewnych różnic patofizjologicznych nie są więc jednostkami o zupełnie odrębnej etiologii i patofizjologii. W wielu przypadkach dochodzi do ewolucji jednej postaci w drugą, a największa częstość rozpoznawania AD wiąże się między innymi z nasileniem objawów i stosunkowo łatwą wizualizacją zmiany. Wzajemne zależności poszczególnych postaci AAS, wspólne cechy kliniczne oraz podobne strategie postępowania pozwalają na traktowanie tych jednostek jako jednego zespołu.
Uszkodzenie urazowe aorty
Odmienną etiologię ma natomiast uszkodzenie urazowe aorty. Może dotyczyć aorty objętej procesem degeneracyjnym lub (przy odpowiednio dużym urazie) również aorty zdrowej. TAR zwykle dotyczy aorty w odcinku zstępującym (poniżej miejsca przyczepu więzadła tętniczego) i należy o niej myśleć u chorego po dużym urazie (najczęściej wypadku komunikacyjnym). Badania autopsyjne ofiar wypadków komunikacyjnych wykazały obecność TAR u około 20% [17]. Rokowanie w TAR jest bardzo niekorzystne – szacuje się, że jedynie 9-14% chorych z TAR zdąży dotrzeć do szpitala, a przeżywalność wynosi jedynie 2% [18].