Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Medycyna sportowa
Czy ból ścięgna Achillesa zapisany jest w genach?
Dr hab. Krzysztof Ficek, prof. nadzw. AWF Katowice
Moda na ruch, zazwyczaj nieujęta w ramy odpowiedniej lekarskiej lub fizjoterapeutycznej kontroli pod względem możliwości podołania obciążeniom psychofizycznym, powoduje lawinowy wzrost liczby uszkodzeń w obrębie narządu ruchu. Badania lekarskie warunkujące uzyskanie dopuszczenia do uprawiania sportu zorganizowanego czy udziału w amatorskich zawodach rekreacji fizycznej, dotyczące określenia wartości parametrów wybranych układów, też nie w pełni wystarczają do uzyskania całościowej wiedzy o jakości ruchu osoby badanej.
Zaburzenie równowagi pomiędzy stanem przygotowania tkankowego a zadawanymi obciążeniami fizycznymi przekłada się na zmniejszenie wydolności danej struktury, co często skutkuje jej uszkodzeniem.
Synergia wyników badań genetycznych i biomolekularnych z globalną analizą jakości aktywności fizycznej umożliwia uniknięcie dolegliwości ścięgna Achillesa.
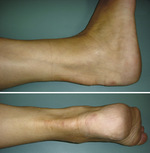
Do jednych z najczęściej występujących kontuzji należą uszkodzenia ścięgna Achillesa (ryc. 1) obserwowane wśród osób uprawiających sport o różnej intensywności, jak również na zróżnicowanym poziomie zaawansowania. Tło uszkodzeń może być ostre, urazowe lub przewlekłe, powstałe na bazie powtarzalnych przeciążeń rozłożonych w czasie.
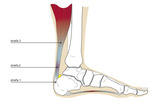
Ryc. 1. Podział ścięgna Achillesa na trzy strefy (1 – przyczep ścięgna do kości piętowej, 2 – strefa krytyczna, 3 – połączenie ścięgnisto-mięśniowe).
Klasyfikacja urazów ścięgna Achillesa
Uszkodzenia ścięgna Achillesa o charakterze nagłym polegają na przerwaniu jego ciągłości podczas jednostkowego dużego obciążenia. Spośród wszystkich patologii tego rodzaju 80 proc. stanowią uszkodzenia ścięgna Achillesa, które rozpoznano przed upływem 14 dni od ich zaistnienia. Pozostałe 20 proc. stanowi zerwanie przewlekłe – rozpoznane dopiero po czterech-sześciu tygodniach od momentu uszkodzenia, co w przypadku sportowców występuje niezwykle rzadko. Wyróżnia się także zmiany o charakterze przewlekłym – bez przerwania ciągłości ścięgna, określane mianem tendinopatii, objawiające się bólem, obrzękiem i sztywnością w obrębie ścięgna (ryc. 2). W literaturze rozróżnia się trzy rodzaje tendinopatii, związane bezpośrednio z lokalizacją objawów:
- przy przyczepie ścięgna do kości piętowej, stanowiące ok. 20-25 proc.,
- w części środkowej (około 2-6 cm proksymalnie od guza piętowego) – 55-66 proc.,
- w części proksymalnej – 9-25 proc.
Tendinopatie można również podzielić na zapalenia ścięgna (tendinitis), które powstają najczęściej w wyniku ostrego przeciążania, oraz na przewlekłe zwyrodnienie ścięgna (tendinosis).
Mechanizm patologii
W mechanizmie zerwania ścięgna Achillesa biorą udział zarówno siły działające bezpośrednio, jak i pośrednio na ścięgno, a także jego skład pod względem budowy, co przekłada się na wytrzymałość. Mimo licznych prac badawczych dokładna etiologia patologii w obrębie ścięgna Achillesa nie jest znana. Jest ona wieloczynnikowa i stanowi rezultat złożonej interakcji szeregu czynników wewnętrznych (wiek, płeć, waga ciała, perfuzja naczyniowa, odżywianie) oraz zewnętrznych (rodzaj aktywności, zawód, obciążenia fizyczne, obuwie oraz warunki środowiskowe), jak również wrodzonych predyspozycji uwarunkowanych podłożem genetycznym. W patogenezie zerwania ścięgna piętowego bierze się pod uwagę m.in. zmiany stosunku ilości kolagenu typu I do kolagenu typu III, zmiany w grubości włókien kolagenowych, choroby autoimmunologiczne, choroby neurologiczne, choroby infekcyjne czy długotrwałe przyjmowanie niektórych leków (np. fluorochinolony, glikokortykosteroidy). Ponieważ zmiany zwyrodnieniowe w obrębie ścięgna prowadzą do spadku jego wytrzymałości i tym samym wiążą się ze zwiększoną podatnością na zerwanie, doprowadziło to do powstania teorii degeneracyjnej zerwania ścięgna piętowego. Degeneracja ta może mieć charakter mukoidowy lub stłuszczeniowy i prowadzi do zaburzenia równowagi między syntezą a rozpadem macierzy pozakomórkowej w obrębie ścięgna.
Druga teoria, zwana mechaniczną, związana jest z aspektem biomechanicznym ścięgna, a więc jego wytrzymałością mechaniczną oraz sprężystością. Nadmierne rozciągnięcie zdrowego ścięgna, w zależności od stopnia, powoduje uszkodzenia mikro- lub makroskopowe, predestynujące do powstania zalążka i propagacji zerwania włókien ścięgna. Największe ryzyko zerwania ścięgna ma miejsce podczas obciążeń szybkich i pośrednich, które występują w czasie ekscentrycznego skurczu mięśni szkieletowych.
Obiecujące zastosowanie genetyki
Badania genetyczne związane z aktywnością fizyczną mają krótką historię. Za ich początek uważa się opublikowanie pracy dotyczącej polimorfizmu w genie ACE (ang. angiotensin-converting enzyme, konwertaza angiotestyny) przez Montgomery’ego w 1998 roku.
Techniki laboratoryjne z zakresu biologii molekularnej w aspekcie badań sportowych zostały wprowadzone na szerszą skalę w drugiej połowie lat 90. XX wieku. Do chwili obecnej spośród około 20 tys. genów kodujących białka, przedmiotem badań prowadzonych przez genetyków sportowych były polimorfizmy w obrębie około 300 genów, z czego jedynie kilkadziesiąt uznano za tzw. markery genetyczne predyspozycji do uprawiania sportu.