Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
W powiększeniu
Zasady racjonalizacji terapii antybiotykowych w schorzeniach układu oddechowego i moczowego
prof. dr hab. n. med. Andrzej M. Fal
dr hab. n. med. Ernest Kuchar
dr n. med. Małgorzata Zaremba
dr hab. n. med. Sławomir Poletajew
prof. CMKP, lek. Jacek Krajewski
dr hab. n. med. Artur Antoniewicz
Odkrycie penicyliny w 1928 r. przez sir Alexandra Fleminga było przełomem w medycynie XX w. Antybiotyki są związkami drobnocząsteczkowymi, które działają w niskich stężeniach bakteriobójczo lub bakteriostatycznie, hamując wzrost lub podziały bakterii. Stanowią niezmiennie podstawę leczenia przyczynowego potencjalnie śmiertelnych zakażeń bakteryjnych, zapobiegając milionom zgonów rocznie1.
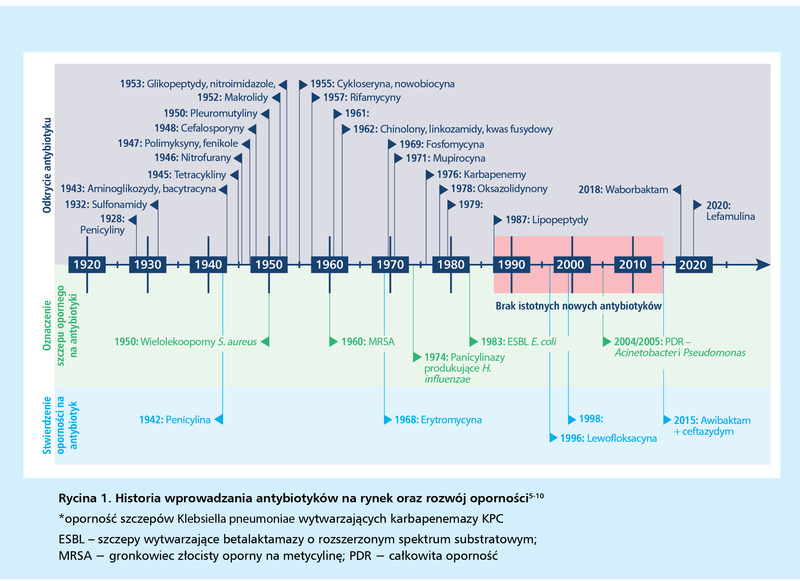
Dzięki wprowadzeniu antybiotykoterapii odsetek zgonów z powodu chorób zakaźnych w krajach rozwiniętych wyraźnie zmniejszył się w porównaniu z rokiem 1900, kiedy to infekcje stanowiły główną przyczynę śmiertelności2. Od 1928 r. opracowano ponad 100 antybiotyków, na lata 1940-1960 przypadła niekwestionowana złota era antybiotyków naturalnych, należących do ponad 20 różnych rodzin chemicznych (ryc. 1)3-5. Jednak już w latach 60. ograniczono poszukiwania nowych leków przeciwdrobnoustrojowych5. Dość szybko okazało się także, że bakterie mogą rozwijać, nabywać i rozprzestrzeniać liczne mechanizmy oporności, czyli braku wrażliwości na działanie antybiotyku, a taka lekooporność aktywizowała się z czasem przeciw każdemu nowemu antybiotykowi2. W raporcie Światowej Organizacji Zdrowia (WHO – World Health Organization) 2021 opisującym rozwój kliniczny i przedkliniczny leków przeciwbakteryjnych wskazano, że pomiędzy lipcem 2017 a listopadem 2021 r. zarejestrowano tylko 12 nowych antybiotyków, z czego 2 należą do nowych rodzin. Są to: waborbaktam (stosowany w skojarzeniu z meropenemem) oraz lefamulina. Z kolei w badaniach klinicznych jest obecnie 27 związków, spośród których jedynie 13 potwierdziło aktywność wobec krytycznych wg WHO szczepów bakterii6. Przy średnim wskaźniku powodzenia, wynoszącym ok. 14% (od I fazy badań klinicznych do zatwierdzenia leku), można oczekiwać, że tylko 7 z tych substancji trafi na rynek w najbliższych 10 latach, a zaledwie 1 lub 2 z nich będą potencjalnie aktywne przeciwko patogenom Gram(-).
Raport ten uwidacznia niedostatek innowacyjnych leków przeciwbakteryjnych, definiowanych jako substancje tworzące nową rodzinę lub działające na nowy punkt uchwytu, o nowym mechanizmie działania czy braku oporności krzyżowej.
Z drugiej strony niewłaściwe stosowanie antybiotyków, a zwłaszcza ich nadużywanie, przyspiesza powstawanie oporności, co w efekcie sprawia, że te leki szybko stają się nieskuteczne. Biorąc pod uwagę brak nowych tego typu leków i niewielką szansę na ich rychłe pojawienie się, jedyną rozsądną drogą jest przeciwdziałanie rozwojowi oporności na dostępne antybiotyki.
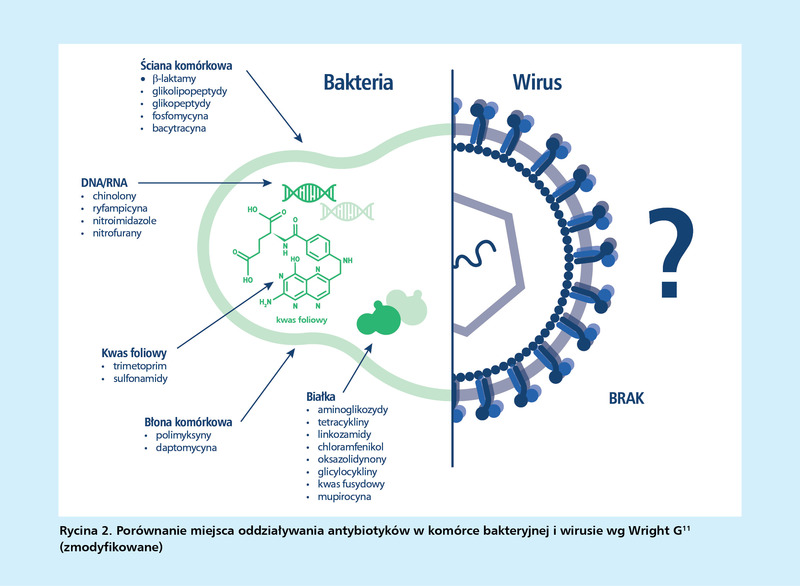
Rozważne stosowanie sprowadza się do przyjmowania antybiotyku w razie uzasadnionej potrzeby, we właściwej dawce, z odpowiednią częstotliwością i przez określony czas. Ponadto antybiotykoterapię należy zlecać wyłącznie w przypadku infekcji o podłożu bakteryjnym, ponieważ tylko komórka bakteryjna ma potencjalne cele oddziaływania dla tych leków (tzw. punkty uchwytu). Wirusy, nie mając struktury komórkowej, pozbawione są miejsc potencjalnego działania antybiotyków, dlatego w przypadku zakażeń wirusowych (np. ostrego zakażenia górnych dróg oddechowych, zapalenia oskrzeli czy grypy) antybiotykoterapia jest zupełnie pozbawiona sensu (brak punktu uchwytu w patogenie = brak przyczynowego działania leku = brak skuteczności) (ryc. 2). Stosowanie antybiotyków przy infekcjach wirusowych jest częstym błędem w terapii i najistotniejszym powodem powstawania antybiotykooporności, czyli de facto niszczeniem skuteczności tych leków. Oporność na antybiotyki występuje, gdy bakterie zmieniają się w odpowiedzi na ich stosowanie. To bakterie (a nie ludzie czy zwierzęta) stają się odporne na antybiotyki.
Różne grupy antybiotyków mają odmienne miejsca oddziaływania w komórce bakteryjnej. Są aktywne mi.in. na poziomie ściany komórkowej, błony komórkowej, syntezy białek (rybosomy) czy kwasów nukleinowych. Antybiotyki zaburzające syntezę ściany komórkowej, uszkadzające błony cytoplazmatyczne lub hamujące syntezę kwasów nukleinowych, nieodwracalnie uszkadzają bakterie i zwykle działają bakteriobójczo. Natomiast skutkiem zahamowania rybosomalnej syntezy białek i procesów przemiany materii jest na ogół działanie bakteriostatyczne – antybiotyki nie powodują obumierania drobnoustrojów, ale utrudniają ich namnażanie w organizmie (ryc. 2). Świadomość mechanizmów działania jest szczególnie istotna, gdy zachodzi potrzeba włączenia do terapii jednocześnie kilku antybiotyków. W takich sytuacjach pacjenci powinni być kierowani do leczenia szpitalnego.
Antybiotykooporność – zakres, przyczyny i świadomość zjawiska
Aleksander Fleming przewidział ryzyko nastania „ery antybiotykooporności” i pojawienia się „superbakterii”, przestrzegał przed niefrasobliwością w stosowaniu antybiotyków, która może stać się przyczyną śmierci drugiego człowieka: „(...) bezmyślna osoba bawiąca się penicyliną jest moralnie odpowiedzialna za śmierć człowieka, który w końcu ulegnie zakażeniu organizmem opornym na penicylinę. Mam nadzieję, że uda się uniknąć tego zła…”.
Stosowanie antybiotyków (niezależnie od tego, czy racjonalne, czy nieuzasadnione) wywiera presję selekcyjną, sprzyjając przeżyciu drobnoustrojów opornych na stosowany antybiotyk. Oporność bakterii wykształca się w sposób naturalny, zazwyczaj za sprawą mutacji genetycznych, jednak nadużywanie antybiotyków wywiera presję na bakterie, znacznie przyspieszając ten proces12. W nabywaniu oporności bakterie wykorzystują kilka mechanizmów: produkują enzymy rozkładające lub inaktywujące leki (np. β-laktamazy), modyfikują/zmieniają miejsce docelowego działania leku (np. synteza nowego białka wiążącego penicylinę, PBP – penicillin binding proteins), aktywnie usuwają lek z komórki (efflux), zaburzają transport do wnętrza komórki [np. zmiana przepuszczalności błony zewnętrznej bakterii Gram(-)]. W wyniku rozwoju lekooporności antybiotyki i inne leki przeciwdrobnoustrojowe tracą wpływ na swoje miejsca oddziaływania w komórce bakterii, a terapia zakażeń staje się coraz trudniejsza lub niemożliwa.
Oporność każdego szczepu bakterii może dotyczyć jednego lub wielu antybiotyków, co skutkuje ograniczeniem skuteczności lub brakiem działania tych leków. W ekstremalnych (np. Klebsiella pneumoniae NDM), ale niestety coraz częstszych już przypadkach dochodzi do oporności bakterii na wszystkie dostępne antybiotyki. WHO uznaje oporność na środki przeciwdrobnoustrojowe za jedno z 10 największych globalnych zagrożeń dla zdrowia publicznego8.
Ponadto antybiotykooporność generuje dodatkowe koszty leczenia, szacowane na poziomie ok. 1,5 mld euro rocznie13,14. Według badań opublikowanych na początku 2019 r., ponad milion zgonów na świecie było spowodowanych przez drobnoustroje oporne na antybiotyki15. W Europie każdego roku dochodzi do ponad 670 tys. antybiotykoopornych infekcji, a ok. 33 tys. osób z tego powodu umiera16. W Polsce, ze względu na brak dokładnych danych, liczbę lekoopornych zakażeń szacuje się na 300-500 tys. rocznie17. Wedle raportu Europejskiego Centrum Profilaktyki i Kontroli Chorób (ECDC – European Centre for Disease Prevention and Control) Polska znajduje się w gronie krajów, w których lekooporność bakterii szczególnie szybko staje się istotnym problemem klinicznym. Dla przykładu w 2016 r., w porównaniu z rokiem 2015, odnotowano wzrost liczby pacjentów zakażonych lekoopornymi szczepami bakterii Klebsiella pneumoniae NDM(+) o 278,7%18. Prognozy pokazują, że jeśli nie zostaną podjęte żadne skuteczne działania prewencyjne, ta liczba może wzrosnąć do 10 mln w 2050 r., czyli więcej ludzi będzie umierało z powodu lekoopornych infekcji niż z przyczyn onkologicznych lub w wyniku wypadków komunikacyjnych19,20.