Kardiologia
Bateria przeciwmiażdżycowa – kto na celowniku?
dr n. med. Sławomir Katarzyński
W skrócie
Większość incydentów klinicznych wywołanych krytycznym niedokrwieniem serca, mózgu czy innych narządów spowodowana jest pęknięciem niestabilnej blaszki miażdżycowej. Wbrew wcześniej panującym opiniom za powstanie krytycznego zwężenia tętnic odpowiada najczęściej nie sama blaszka, lecz wytworzona na niej skrzeplina. Praktycznie żadna z dostępnych obecnie metod obrazowania nie pozwala identyfikować takich niestabilnych zmian miażdżycowych, służą one bowiem przede wszystkim identyfikowaniu istotnych hemodynamicznie zwężeń tętnic. Skoro więc nie potrafimy za pomocą metod obrazowania zidentyfikować osób z niestabilnymi blaszkami miażdżycowymi, a więc z bardzo wysokim ryzykiem powikłań sercowo-naczyniowych, pozostaje nam jedynie polegać na ocenie ryzyka całkowitego prowadzonej w oparciu o analizę szeregu danych klinicznych. Identyfikacja osób obciążonych wysokim ryzykiem powikłań sercowo-naczyniowych jest kluczowa, ponieważ agresywne zwalczanie czynników sprzyjających rozwojowi miażdżycy przynosi u nich bardzo dobre rezultaty. Co więcej, badania z ostatnich lat udowodniły, że regresja zmian miażdżycowych jest możliwa, jeżeli tylko uda się obniżyć stężenie cholesterolu LDL do odpowiednio niskich wartości.
Wstęp
Miażdżyca jest przewlekłym procesem zapalnym zajmującym ogniskowo przede wszystkim tętnice dużego i średniego kalibru. Jej objawy kliniczne występują zazwyczaj dopiero w wieku dorosłym, podczas gdy same blaszki miażdżycowe stwierdza się w naczyniach już w okresie wczesnego dzieciństwa. Za rozwój miażdżycy odpowiedzialnych jest wiele czynników genetycznych i środowiskowych, które mimo wielu lat badań i obserwacji są słabo poznane. Dotyczy to w szczególności czynników genetycznych. Wiadomo na przykład, że jednym z najsilniejszych czynników ryzyka jest wystąpienie choroby naczyniowej w młodym wieku u rodziców i rodzeństwa, jednak badania prowadzone w rodzinach wysokiego ryzyka rzadko pozwalają zidentyfikować defekt genetyczny odpowiedzialny za przedwczesny rozwój miażdżycy. Poszukiwania „genu miażdżycy” trwają, nie przynosząc jak dotąd rezultatów.
Zidentyfikowano oczywiście szereg czynników ryzyka rozwoju miażdżycy, m.in. hipercholesterolemię, nadciśnienie tętnicze, cukrzycę czy palenie tytoniu. Wystąpienie każdego z nich (poza paleniem) może być jednak zarówno uwarunkowane genetycznie (np. rodzinna hipercholesterolemia), jak i stanowić konsekwencję stylu życia oraz odżywiania. W badaniach epidemiologicznych, dzięki którym zdefiniowano te czynniki, nie analizowano ich etiologii, a zatem nie ma pewności, czy zawsze mają jednakowe znaczenie.
Ze względu na lokalizację narządową zmian miażdżycowych za osobne jednostki chorobowe uznaje się m.in. chorobę wieńcową, chorobę naczyniową mózgu czy miażdżycę tętnic obwodowych, trzeba jednak pamiętać, że miażdżyca może także prowadzić do krytycznego niedokrwienia jelit (zajęcie pnia trzewnego/naczyń kreskowych), powstawania tętniaków aorty, szczególnie w odcinku brzusznym, niewydolności nerek czy nadciśnienia nerkowo-naczyniowego (zwężenie tętnicy nerkowej). Traktowanie tych stanów jako osobnych jednostek chorobowych podyktowane jest po części tym, że ich diagnostyką i leczeniem zajmują się specjaliści różnych dziedzin, tymczasem rozgraniczenia te są często sztuczne. Znacznie bliższe rzeczywistości wydaje się traktowanie miażdżycy jako choroby ogólnoustrojowej, dającej różne objawy w zależności od lokalizacji najbardziej zaawansowanych zmian i stylu życia pacjenta.1
Nie dziwi więc, że zajęcie jednej grupy tętnic wiąże się z dużym ryzykiem obecności zmian miażdżycowych w innych tętnicach, nawet jeśli nie występują objawy kliniczne na to wskazujące. Szacuje się, że u ok. 46% osób z chorobą wieńcową stwierdza się zmiany w tętnicach obwodowych, a 58% pacjentów z miażdżycą w tętnicach obwodowych ma zmiany także w tętnicach wieńcowych. Można śmiało założyć, że gdyby do poszukiwania miażdżycy w różnych obszarach naczyniowych zastosować metody diagnostyczne o wyższej czułości, np. ultrasonografię wewnątrznaczyniową, odsetki te byłyby znacznie wyższe.
Niestabilna blaszka miażdżycowa
Obecnie wiemy, że za ogromną większość klinicznych incydentów naczyniowych na podłożu miażdżycowym odpowiedzialne są tzw. niestabilne blaszki. Najczęściej nie są to zmiany zwężające naczynie krytycznie czy nawet umiarkowanie, jednak w wyniku uszkodzenia pokrywającej je włóknistej warstwy wierzchniej i śródbłonka dochodzi do wytworzenia się na ich powierzchni skrzepliny, która zamyka światło tętnicy, lub do uwolnienia z wnętrza blaszki elementów morfotycznych, które niesione z prądem krwi zatykają obwodowe naczynia mniejszego kalibru. Wykazano, że niestabilne blaszki charakteryzują się dużym rdzeniem lipidowym, obecnością licznych wzbudzonych makrofagów obładowanych oksydowanymi cząsteczkami LDL, nasilonym procesem zapalnym, zmniejszoną syntezą kolagenu, zwiększoną ekspresją kolagenaz oraz nasiloną apoptozą komórek mięśni gładkich.2 To właśnie destabilizacja blaszek jest punktem zwrotnym w ciągu zdarzeń prowadzących do wystąpienia najgroźniejszych, klinicznych incydentów naczyniowych – zawału mięśnia sercowego, udaru mózgu, przemijającego niedokrwienia mózgu (TIA – transient ischemic attack), krytycznego niedokrwienia kończyny czy jelit. By móc skutecznie zapobiegać takim incydentom, należy nauczyć się wykrywać niestabilne blaszki i identyfikować osoby, u których ryzyko powikłań sercowo-naczyniowych jest wysokie, a w dalszej kolejności ograniczać niestabilność blaszek przez odpowiednie leczenie. Tymczasem w codziennej praktyce klinicznej dostępne metody diagnostyczne umożliwiają poszukiwanie zmian w tętnicach powodujących ich istotne hemodynamicznie zwężenie, a więc wcale nie takich, które najczęściej są odpowiedzialne za występowanie ostrych incydentów klinicznych.
Metody obrazowania
By lepiej zrozumieć, dlaczego tak trudno jest zidentyfikować osoby obciążone najwyższym ryzykiem powikłań sercowo-naczyniowych w związku z występowaniem u nich niestabilnych blaszek miażdżycowych, konieczne jest omówienie ograniczeń stosowanych współcześnie metod obrazowania. Tradycyjnie za badanie referencyjne w diagnostyce naczyniowej uznaje się klasyczną angiografię. Jako badanie opierające się na dwuwymiarowym obrazowaniu światła naczynia dostarcza ona tylko pośrednich i skąpych danych o strukturze ściany tętnicy, nie wnosząc nic do oceny stopnia niestabilności blaszek. Pozwala jedynie dostrzec skutki pęknięcia niestabilnej blaszki w postaci zamknięcia lub krytycznego zwężenia naczynia w sytuacji wystąpienia ostrego niedokrwienia. Trzeba pamiętać, że w naturalnym procesie rozwoju miażdżycy tworzące się złogi wnikają w ścianę tętnicy, uwypuklając ją znacząco na zewnątrz. Do światła naczynia wpukla się jedynie fragment blaszki, na podobieństwo czubka góry lodowej wystającego z wody. Ponieważ obrazowanie metodą wielorzędowej tomografii komputerowej również bazuje na wizualizacji strumienia krwi po dożylnym podaniu środka kontrastowego, także ta metoda nie może wystarczająco dobrze obrazować ścian naczyń, a zatem jest nieprzydatna w identyfikacji blaszek niestabilnych.
Znacznie więcej informacji o strukturze ściany naczyniowej dają badania ultrasonograficzne. W codziennej praktyce powszechnie wykorzystuje się je w obrazowaniu tętnic szyjnych, kręgowych, aorty brzusznej wraz z odgałęzieniami oraz tętnic kończyn dolnych. W ocenie globalnego ryzyka sercowo-naczyniowego uwzględnia się m.in. grubość kompleksu błony wewnętrznej i środkowej (IMT – intima-media thickness) tętnicy szyjnej wspólnej. W szeregu badań klinicznych pomiary objętości blaszek miażdżycowych na rozwidleniu tej tętnicy były podstawą oceny, czy intensywne leczenie przeciwmiażdżycowe prowadzi do jej regresji. Niestety, badania naczyń wykonywane „od zewnątrz” są zbyt mało dokładne, by na ich podstawie można było wnioskować o składzie poszczególnych blaszek. Kamieniem milowym w przyżyciowym obrazowaniu struktury tętnic okazała się ultasonografia wewnątrznaczyniowa (IVUS – intravascular ultrasound). Pozwala ona nie tylko precyzyjnie oceniać parametry takie, jak pole powierzchni światła naczynia czy objętość blaszek miażdżycowych w poszczególnych segmentach naczyń, ale dzięki rozdzielczości przestrzennej rzędu 150 μm umożliwia również charakteryzowanie ich składu. Struktury zawierające dużo złogów lipidowych są w IVUS hipoechogenne, zmiany zwłókniałe z dużą zawartością komórek mięśni gładkich cechuje hiperechogenność, a zwapnienia generują cień akustyczny. Cyfrowa obróbka danych pozyskiwanych podczas skanowania metodą IVUS pozwala na półautomatyczną identyfikację poszczególnych składników blaszek – technikę tę określa się mianem wirtualnej histologii (VH-IVUS – virtual histology IVUS). To właśnie dzięki technice ultrasonografii wewnątrznaczyniowej udowodniono, że możliwa jest regresja blaszek miażdżycowych w wyniku intensywnego leczenia hipolipemizującego statynami (badanie ASTEROID z rozuwastatyną).3 Niestety, rozdzielczość IVUS jest zbyt niska, by za jej pomocą można było uwidocznić i zmierzyć grubość wierzchniej warstwy włóknistej pokrywającej blaszki. A właśnie ona decyduje w znacznej mierze o stabilności lub niestabilności blaszek.
Ponad 10-krotnie większą rozdzielczość przestrzenną obrazowania oferuje najnowsza technika – koherencyjna tomografia optyczna (OCT – optical coherence tomography). Po raz pierwszy zastosowano ją w 1991 r. i początkowo służyła do badania struktur przeziernych. Szybko jednak dostrzeżono jej potencjał i zmodyfikowano do zastosowań wewnątrznaczyniowych. W dużym uproszczeniu badanie polega na spiralnym skanowaniu naczynia wiązką jednorodnego światła o długości fali odpowiadającej bliskiej podczerwieni i analizie widma światła odbitego. Ponieważ częstotliwość fal elektromagnetycznych jest wielokrotnie wyższa niż ultradźwięków, rozdzielczość obrazów generowanych tą techniką jest również znacznie większa. Najmniejszy element identyfikowany jako pojedynczy punkt ma wielkość zaledwie 10 μm, co wystarcza do precyzyjnego obrazowania blaszek miażdżycowych, łącznie z pomiarem grubości wierzchniej warstwy włóknistej (ryc. 1).
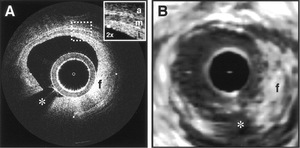
Rycina 1. Porównanie obrazu tego samego przekroju naczynia uzyskanego za pomocą koherentnej tomografii optycznej (A) i ultrasonografii wewnątrznaczyniowej (B)
Jednocześnie samo skanowanie trwa niezwykle krótko i jest zbliżone technicznie do sposobu wykonywania badania IVUS.2 Ma to niebagatelne znaczenie, gdyż dla operatorów doświadczonych w technice IVUS zamiana metody na OCT wiąże się tylko z opanowaniem obsługi konsoli zewnętrznej i zastosowaniem innych sond wewnątrznaczyniowych.
Należy oczekiwać burzliwego rozwoju metody OCT, która jako pierwsza pozwala na przyżyciowy wgląd w blaszkę miażdżycową i identyfikację zmian niestabilnych. Z pewnością też za kilka lat ogłoszone zostaną wyniki badań nad regresją miażdżycy, wykorzystujących właśnie tę metodę diagnostyczną. Wówczas okaże się, czy zgodnie z oczekiwaniami zmniejszaniu się blaszek, dowiedzionemu dzięki zastosowaniu badania IVUS i będącemu wynikiem leczenia, towarzyszy korzystna zmiana ich struktury i stabilizacja.
Wiele do zaoferowania ma też obrazowanie metodą rezonansu magnetycznego (MRI – magnetic resonance imaging), trzeba jednak zaznaczyć, że ze względu na długie czasy skanowania technika ta nie nadaje się do obrazowania będących w ciągłym ruchu tętnic wieńcowych. Najlepiej sprawdza się w badaniach tętnic szyjnych, dzięki odpowiednim protokołom bardzo dokładnie identyfikuje bogato lipidowy rdzeń martwiczy blaszek oraz wierzchnią warstwę włóknistą, pozwalając na dokładne pomiary jej grubości. Z bardzo dobrym efektem obrazowanie metodą rezonansu magnetycznego wykorzystano m.in. w badaniu ORION (Rosuvastatin therapy on carotid plaque morphology and composition in moderately hypercholesterolemic patients) oceniającym wpływ rozuwastatyny na wielkość i skład blaszek miażdżycowych w tętnicach szyjnych.4 Stosując środki kontrastowe zawierające gadolin, który penetruje do blaszek, można ocenić stopień ich neowaskularyzacji, a jak wiadomo, jest to jeden z parametrów wpływających na stabilność zmian. Co więcej, dzięki nowemu środkowi cieniującemu zawierającemu ultramałe superparamagnetyczne cząsteczki tlenku żelaza (USPIO – ultra-small superparamagnetic iron oxide) możliwe stało się monitorowanie intensywności procesu zapalnego w blaszkach. Cząsteczki te są wychwytywane przez makrofagi, intensywność sygnału jest zatem proporcjonalna do zawartości tych komórek w blaszkach.2
Podsumowując, nie dysponujemy praktycznie żadną nieinwazyjną metodą obrazowania pozwalającą identyfikować przyżyciowo niestabilne blaszki miażdżycowe, a więc takie, które stwarzają największe zagrożenie poważnymi incydentami klinicznymi. Dotyczy to w szczególności tętnic wieńcowych, które ze względu na ruchomość nie nadają się do obrazowania metodą rezonansu megnetycznego. Wielkie nadzieje wiązać należy z koherencyjną tomografią optyczną, która z pewnością stanie się jednym z głównych narzędzi w rękach klinicystów. Jest to jednak badanie inwazyjne i nie nadaje się do stosowania jako test przesiewowy.