Sympozjum: wszystko, co chcecie wiedzieć o statynach, ale...
Pleotropowe działanie statyn w leczeniu zaburzeń lipidowych
Maureen E. Mays, MD, MS
Carlos A. Dujovne, MD
W SKRÓCIE
Choroby serca i naczyń są w krajach rozwiniętych główną przyczyną zgonów. W badaniach klinicznych z zastosowaniem inhibitorów reduktazy 3-hydroksy-3-metyloglutarylokoenzymu A (statyn) wykazano zmniejszenie chorobowości i śmiertelności z jej powodu, co istotnie wpłynęło na zmianę podejścia do terapii hipolipemizującej. Od 2001 r. kolejne analizy wskazywały ponadto, że statyny zadziwiająco szybko przynoszą korzyści kliniczne. Powstała hipoteza, że wykazują one dodatkowe działania poza obniżeniem stężeń lipidów w surowicy. Korzyści osiągane za pomocą statyn stały się więc podstawą teorii, że leki te wykazują inne lub współistniejące z hipolipemicznym działania, które odgrywają rolę w szybkości i nasileniu korzystnego wpływu sercowo-naczyniowego. Nazwano je działaniami pleotropowymi statyn. Do działań pleotropowych niezależnych od wpływu hipolipemizującego należą działanie przeciwzakrzepowe, przeciwzapalne i antyoksydacyjne oraz stabilizacja blaszki miażdżycowej i poprawa właściwości naczyniorozkurczowych śródbłonka wpływająca na obniżenie ciśnienia wewnątrztętniczego i zwiększenie przepływu krwi.
Wprowadzenie
Choroby sercowo-naczyniowe są głównymi przyczynami zgonów w krajach rozwiniętych. Od 1988 r., czyli od czasu pierwszego wydania amerykańskich wytycznych dotyczących leczenia zaburzeń lipidowych znanych pod nazwą National Cholesterol Education Program (NCEP) Adult Treatment Panel (ATP),1 pierwszorzędowym celem interwencji mającej na celu ograniczenie ryzyka sercowo-naczyniowego stała się kontrola stężenia cholesterolu związanego z lipoproteinami o niskiej gęstości (LDL-C). W badaniach Framingham, Multiple Risk Factor Intervention Trial (MRFIT) i Coronary Drug Project wykazano występowanie korelacji między stężeniem LDL-C a ryzykiem sercowo-naczyniowym. Na podstawie badań angiograficznych i dużych metaanaliz badań klinicznych w drugim wydaniu wytycznych NCEP-ATP z 1993 r. określono konkretne cele interwencji korygujących zaburzenia lipidowe,2 wśród których było m.in. zmniejszenie stężenia LDL-C do ≤100 mg/dl u pacjentów z chorobami sercowo-naczyniowymi. W 1994 r. za sprawą publikacji wyników Scandinavian Simvastatin Survival Study (4S)3 wykazanie, że duża skuteczność inhibitorów reduktazy 3-hydroksy-3-metyloglutarylokoenzymu A (statyn) w zmniejszaniu stężenia LDL-C wpływa na redukcję ryzyka sercowo-naczyniowego, zmieniło podejście do korekcji zaburzeń lipidowych. W badaniu 4S stosowanie simwastatyny o 42% zmniejszyło umieralność z powodu choroby sercowo-naczyniowej i o 30% całkowitą śmiertelność, co potwierdziły następne podobne badania kliniczne statyn. Stało się więc oczywiste, że znaczące zmniejszenie stężenia LDL-C uzyskane dzięki zastosowaniu statyn poprawia wyniki zarówno prewencji wtórnej, jak i pierwotnej w chorobie sercowo-naczyniowej, zmniejszając przy tym śmiertelność całkowitą.3-5 Te doskonałe, niestwierdzane wcześniej w badaniach klinicznych korzyści z leczenia statynami doprowadziły do powstania trzeciej wersji wytycznych ATP (ATP III),6 w których na podstawie rzetelnych dowodów medycznych zachowano zasadę, że utrzymanie docelowych stężeń LDL-C jest pierwszorzędowym celem interwencji korygujących zaburzenia lipidowe w celu redukcji ryzyka chorób układu krążenia.
Od czasu publikacji ATP III w 2001 r. w kolejnych badaniach koncentrowano się na wczesnych korzyściach z zastosowania statyn, zwłaszcza w dużych dawkach, czego przykładem jest badanie Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 (PROVE IT-TIMI 22).7 W ciągu 2 lat porównywano w nim zastosowanie atorwastatyny w dawce 80 mg/24h i prawastatyny w dawce 40 mg/24h u chorych z ostrym zespołem wieńcowym. Stwierdzono, że intensywne leczenie statyną przynosi istotne korzyści kliniczne już po 4 miesiącach, co sugeruje, że statyny mają jeszcze inne działania poza działaniem hipolipemizującym prowadzącym do regresji zmian miażdżycowych w naczyniach.7 W innych badaniach, takich jak Prospective Study of Pravastatin in the Elderly at Risk (PROSPER)8 czy Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm (ASCOTT-LLA),9 także wykazano istotną redukcję ryzyka sercowo-naczyniowego po stosunkowo krótkim czasie stosowania statyn w prewencji pierwotnej i wtórnej. W badaniach statyn, w których oceniano ich działanie za pomocą ultrasonografii wewnątrznaczyniowej, nie stwierdzano istotnych zmian wielkości blaszek miażdżycowych. Wyjątkiem jest badanie A Study to Evaluate the Effect of Rosuvastatin on Intravascular Ultrasound-Derived Coronary Atheroma Burden (ASTEROID),10 w którym obserwowano regresję zmian miażdżycowych, prawdopodobnie uzyskaną po zastosowaniu rosuwastatyny, która wpłynęła na zmniejszenie stężenia LDL-C do średniej wartości 60,8 mg/dl i na znaczniejsze niż w innych próbach zwiększenie stężenia cholesterolu związanego z lipoproteinami o dużej gęstości (HDL-C). Te stosunkowo krótko trwające badania nad statynami doprowadziły do utrwalenia się hipotezy, że leki tej grupy mają jeszcze inne, być może niezależne od hipolipemizującego, działania, które przyczyniają się do znaczącej redukcji ryzyka sercowo-naczyniowego w chorobie układu krążenia. Dodatkowe korzystne działania statyn nazwano działaniami pleotropowymi.
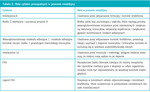
Istnieje wiele hipotez na temat działań pleotropowych statyn. Celem niniejszego artykułu jest przeanalizowanie możliwych sposobów redukcji ryzyka sercowo-naczyniowego przez statyny, które to sposoby są niezależne od hipolipemizującego działania leków tej grupy, polegającego na zmniejszeniu stężenia LDL-C i zwiększeniu stężenia HDL-C. Do potencjalnych działań pleotropowych statyn, niezależnych od wpływu hipolipemizującego, należą działania przeciwzakrzepowe, przeciwzapalne i antyoksydacyjne oraz stabilizacja blaszki miażdżycowej i poprawa właściwości naczyniorozkurczowych śródbłonka wpływająca na obniżenie ciśnienia wewnątrztętniczego i zwiększenie przepływu krwi.11-13 Zestawienie działań pleotropowych statyn znajduje się w tabeli 1.
Na niektóre działania zawarte w tabeli 1 wpływają LDL-C i HDL-C, dlatego trudno jest w pełni zrozumieć, czy określone działanie statyn jest niezależne, czy też związane z korekcją zaburzeń lipidowych przez statyny.
Zakrzepica
Hipercholesterolemia i zwiększone stężenie lipoproteiny(a) [Lp(a)] wiążą się zarówno ze zwiększeniem reaktywności płytek, jak i z aktywacją osoczowych czynników krzepnięcia, zatem zmniejszenie stężenia LDL-C, czemu niemal zawsze towarzyszy zmniejszenie zagrożenia związanego z Lp(a), to interwencja, po której można się spodziewać redukcji ryzyka zakrzepicy prowadzącej do ostrych zespołów wieńcowych. Statyny mają jednak także inne działania, dzięki którym niezależnie od wpływu na lipidogram zmniejszają ryzyko powikłań zakrzepowych. Dobrze scharakteryzowane jest hamowanie agregacji płytek krwi przez tlenek azotu (NO). Statyny powodują zwiększenie ekspresji śródbłonkowej syntazy NO, a przez to rozkurcz naczyń krwionośnych i zmniejszenie agregacji płytek krwi.12,13 Opisane działanie wydaje się niezależne od wpływu statyn na lipidy. W okresie poprzedzającym dominację statyn Zucker i wsp.14 przeprowadzili badanie z zastosowaniem żywic jonowymiennych, w którym u pacjentów z hipercholesterolemią uzyskali co najmniej 30% zmniejszenie stężenia LDL-C. Mimo znacznych zmian lipidogramu nie stwierdzono różnic pod względem agregacji płytek, wytwarzania tromboksanu, wrażliwości na prostacykliny, czynnik płytkowy 4 i β-tromboglobulinę między grupą leczonych żywicami a grupą kontrolną, której podawano placebo.14
Prawdopodobnie statyny zmniejszają też wytwarzanie tromboksanu A2 i inhibitora 1 aktywatora plazminogenu, a więc oddziałują na kolejne mechanizmy regulacyjne, które powodują aktywację płytek i zakrzepicę. Powyższe wnioski pochodzą z badań przeprowadzonych in vitro i na modelach zwierzęcych, ale trudno je potwierdzić w badaniach klinicznych.12 Wykazano za to, że przewlekłe stosowanie statyn powoduje znaczące zmniejszenie stężenia fibrynogenu, zwiększenie stężenia aktywatora plazminogenu typu tkankowego i zmniejszenie zawartości fosfolipidów w błonie komórkowej płytek krwi.15,16 W badaniu, w którym stosowano atorwastatynę w dawce 80 mg/24h przez 12 tygodni, co prawda nie zaobserwowano zmian stężenia fibrynogenu, ale stwierdzono znaczące zmniejszenie lepkości krwi oraz indukowanych kwasem arachidonowym wzrostów liczby płytek krwi i stężenia VII czynnika krzepnięcia.17 Te znaczące zmiany lepkości krwi, jak również innych parametrów procesu hemostazy prawdopodobnie są niezależne od wpływu statyn na zmniejszenie stężenia fibrynogenu, ponieważ jest to zjawisko bardzo zmienne, co potwierdzono w badaniach klinicznych. W jednym z badań nad statynami, w którym wykonywano endarterektomię tętnic szyjnych, analizowano histologicznie blaszki miażdżycowe u pacjentów, których przed zabiegiem przydzielono w sposób losowy do grupy leczonej statyną lub grupy otrzymującej placebo. W materiale pobranym od leczonych statyną stwierdzono małe i nieznamienne statystycznie zmniejszenie zawartości czynnika tkankowego.18
Zagrożenie zakrzepicą w chorobie sercowo-naczyniowej jest ściśle związane z komórkami śródbłonka. Zrodziło to przypuszczenia, że bardziej lipofilne statyny [statyny hydrofilne to prawastatyna i fluwastatyna; pozostałe statyny są lipofilne – przyp. tłum.] o dłuższym okresie półtrwania w surowicy [większość statyn ma krótki okres półtrwania – ok. 2-3 h; atorwastatyna – 14 h, a jej aktywne metabolity – 20-20 h; rosuwastatyna – 19 h – przyp. tłum.] mogą w większym stopniu zmniejszać ryzyko sercowo-naczyniowe, ponieważ wykazują silniejsze działania pleotropowe. Wyniki kilku badań nad prawastatyną nie potwierdziły korzyści obserwowanych wcześniej w trakcie leczenia atorwastatyną.12,19 Poza różnicami dotyczącymi okresu półtrwania stwierdzono także znaczące różnice w obniżaniu stężenia LDL-C przez różne statyny (najbardziej skuteczne są atorwastatyna i rosuwastatyna), co utrudnia interpretowanie wyników badań klinicznych w kontekście własności lipofilnych lub lipofobowych poszczególnych leków tej grupy.
Prawdopodobnie najistotniejszy wpływ na działanie przeciwzakrzepowe statyn mają dwa mechanizmy pleotropowe tych leków, które oddziałują na stan zapalny i procesy zależne od rodników tlenowych. Utlenowane LDL w pasmach tłuszczowych i w blaszkach miażdżycowych w okresie tworzenia oddziałują chemotaktycznie, a przez to nasilają śródbłonkową adhezję monocytów i makrofagów. To powoduje aktywację układu dopełniacza i dodatkowych jeszcze molekuł adhezyjnych, takich jak metaloproteinazy macierzy i czynnik tkankowy. W związku z tym zwiększa się adhezja płytek krwi do śródbłonka, a rozwój blaszki miażdżycowej postępuje. Działanie przeciwzakrzepowe statyn może być też skutkiem przeciwzapalnych właściwości leków tej grupy.
Zapalenie
U pacjentów z przewlekłymi schorzeniami zapalnymi, takimi jak choroby reumatyczne lub zapalenie przyzębia, w porównaniu z dobranymi pod względem czynników demograficznych osobami w populacji, które nie są obciążone chorobami zapalnymi, choroba sercowo-naczyniowa występuje 10 lat wcześniej.20,21 Wiele mierników zapalenia pozytywnie koreluje ze zdarzeniami klinicznymi w przebiegu choroby układu krążenia.22,23 Co więcej, występowanie czynników ryzyka sercowo-naczyniowego, takich jak zwiększenie stężenia LDL-C, zespół metaboliczny, nadciśnienie tętnicze, palenie tytoniu czy otyłość, prowadzi do zwiększenia markerów zapalenia we krwi. W związku z tym przeprowadzono badania w celu rozstrzygnięcia, czy zaburzenia lipidowe lub nadciśnienie tętnicze to niezależne czynniki ryzyka sercowo-naczyniowego, czy też aktywują one stan zapalny, który jest najważniejszym bezpośrednim czynnikiem ryzyka. Udało się ustalić, że klasyczne czynniki ryzyka są czynnikami niezależnymi, ale współwystępujący stan zapalny dodatkowo nasila ryzyko. Być może dlatego u niektórych osób obserwuje się szybki rozwój choroby sercowo-naczyniowej w porównaniu z innymi o takim samym profilu czynników ryzyka. Takie stwierdzenie wpłynęło na bardzo duże zainteresowanie zapaleniem i zakażeniami w patogenezie choroby sercowo-naczyniowej. W badaniach klinicznych, w których do standardowej terapii chorób sercowo-naczyniowych rozwijających się na podłożu miażdżycy dołączano leczenie przeciwbakteryjne, nie wykazano jednak dodatkowych korzyści takiej interwencji.24
W zmianach miażdżycowych o różnym zaawansowaniu, od pasm tłuszczowych do zmian typu IV [zmiany miażdżycowe są dzielone na 4 typy: typ I – zmiana początkowa; typ II – pasmo tłuszczowe; typ III – zmiana przejściowa między typem II i IV; typ IV – blaszka miażdżycowa – przyp. tłum.], w śródbłonku i blaszkach stwierdza się komponenty procesu zapalnego (tab. 2). Markery ostrej fazy, takie jak białko C-reaktywne (CRP), są uważane za ważne wskaźniki ryzyka sercowo-naczyniowego.25 Mimo licznych badań w wytycznych ATP III nie sformułowano zalecenia powszechnego oznaczania stężenia CRP ani mniej znanych wskaźników zapalnych. Być może wynika to z faktu, że trudno oddzielić wpływ statyn na CRP i na LDL-C. W badaniach z udziałem osób z małym stężeniem LDL-C stężenie CRP oznaczanego metodą wysokiej czułości (hs-CRP) nie miało znaczenia rokowniczego, podczas gdy jest to dodatkowy czynnik rokowniczy u osób z dużym stężeniem LDL-C. W badaniu z udziałem chorych z ostrymi zespołami wieńcowymi Ridker i wsp.23 wykazali, że u pacjentów, u których pod wpływem stosowania statyn stężenie LDL-C wynosiło <70 mg/dl, a stężenie CRP <1 mg/l, rzadziej występowały nawroty powikłań niż u tych, którzy mieli identyczne stężenie LDL-C i zwiększone stężenie hs-CRP. Można przypuszczać, że korelacja między stężeniami LDL-C i CRP zaczyna się od określonej, znacznie większej niż zazwyczaj redukcji stężenia LDL-C. W 2007 r. w metaanalizie 23 badań Kinlay26 oszacował, że w 89-98% na stężenie hs-CRP ma wpływ obniżenie stężenia LDL-C, a w 2-11% jest ono niezależne od lipidów, a więc wynika z pleotropowego działania statyn.
Badania innych markerów zapalenia w chorobie sercowo-naczyniowej są na wczesnym etapie, ale przynoszą obiecujące wyniki. Być może bardziej swoistym markerem zapalenia związanym z ryzykiem sercowo-naczyniowym jest interleukina-6 (IL-6), która po uwolnieniu z komórek śródbłonka i dotarciu do wątroby powoduje nasilenie syntezy CRP. Na razie ilościowe oznaczenia tej interleukiny nie są łatwe ze względu na jej małe stężenie w surowicy. Zapewne przełomem okaże się wprowadzenie metod analitycznych o dużej czułości do oznaczania IL-6.
Kliniczne badania markerów zapalenia są trudne, ponieważ analizowane procesy toczą się na poziomie molekularnym aktywowanego śródbłonka, a uczestniczą w nich także prozapalne cytokiny wpływające na rekrutację komórek układu odpornościowego i LDL-C. Czynniki prozapalne zwiększają także stężenie metaloproteinaz macierzy, które współuczestniczą w zakrzepicy na blaszkach miażdżycowych.27 Są także dowody, że surowiczy amyloid-A może powodować usuwanie apolipoproteiny A-I z cząsteczek HDL, a przez to zmniejszać czynność tych ochronnych lipoprotein.23 To kolejny czynnik nasilający proliferację błony wewnętrznej z akumulacją utlenowanych LDL i destabilizujący blaszki.