Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Sympozjum: astma oskrzelowa
Oporność na glikokortykosteroidy w astmie: mechanizmy patogenetyczne i sposoby postępowania
Ian M. Adcock, PhD
Paul A. Ford, MD, PhD
Pank Bhavsar, PhD
Tehireem Ahmad, BSc
Kian Fan Chung, MD, PhD
W SKRÓCIE
Oporność na glikokortykosteroidy u chorych na astmę stanowi istotny problem leczniczy, ponieważ klasyczne metody terapii są nieskuteczne. Glikokortykosteroidy działają na receptor glikokortykosteroidowy (GR), co wiąże się z aktywacją wielu różnych mechanizmów, w tym z udziałem jądrowego czynnika κB, kompleksu aktywacyjnego białka aktywatorowego-1 i kinazy aktywowanej mitogenem, przez które dokonuje się wybiórcze zahamowanie ekspresji genów dla mediatorów stanu zapalnego. W zależności od analizowanego modelu obserwuje się aktywację różnych substancji sygnałowych, a charakter i nasilenie reakcji na glikokortykosteroidy może wynikać z różnic w stężeniu, w czasie rozpoczęcia stosowania leku, w nasileniu ekspresji receptora glikokortykosteroidowego oraz charakterze bodźca zapalnego. Nadmierna aktywacja różnych szlaków przesyłania sygnałów może mieć istotny wpływ na brak skuteczności glikokortykosteroidów u chorych na astmę oporną na leki tej grupy (astma steroidooporna). Dokładne poznanie molekularnych mechanizmów działania lub braku działania glikokortykosteroidów może przyczynić się do opracowania nowych leków o działaniu przeciwzapalnym lub umożliwić opracowanie metody odwracania oporności na glikokortykosteroidy – zjawiska występującego u części chorych na astmę ciężką.
Wprowadzenie
Glikokortykosteroidy, początkowo pod postacią kortyzonu, po raz pierwszy zostały zastosowane w leczeniu astmy ponad 60 lat temu, przynosząc bardzo istotny efekt kliniczny.1 Zastosowanie glikokortykosteroidów wziewnych w leczeniu astmy znacząco poprawiło stosunek korzyści do ryzyka leczenia. Stało się to głównie za sprawą zmniejszenia wchłaniania leku do krążenia i zmniejszenia ryzyka ogólnoustrojowych działań niepożądanych. Obecnie glikokortykosteroidy wziewne to leki z wyboru dla wszystkich chorych na astmę, którzy wymagają regularnego leczenia, żeby uzyskać zadowalającą kontrolę choroby i zmniejszyć ryzyko zaostrzeń.1 Ich skuteczność przynajmniej częściowo wynika ze zmniejszenia nadreaktywności oskrzeli oraz złagodzenia eozynofilowego i limfocytarnego stanu zapalnego dróg oddechowych.1 W kilku doniesieniach wykazano, że glikokortykosteroidy wziewne mogą też w pewnym zakresie odwracać następstwa przebudowy dróg oddechowych, jak pogrubienie błony podstawnej.2
Definicja niewrażliwości na glikokortykosteroidy
Choć u większości chorych na astmę obserwuje się dobrą odpowiedź na glikokortykosteroidy, coraz wyraźniej widać, że istnieje grupa pacjentów, którzy odnoszą mniejsze korzyści z leczenia glikokortykosteroidami stosowanymi ogólnoustrojowo lub miejscowo.1 Ogólnie skuteczność stosowania glikokortykosteroidów opisuje rozkład jednomodalny (z jedną wartością maksymalną), ale pewna część chorych przejawia ekstremalne reakcje na leki tej grupy (znaczny efekt lub oporność).1 Celem wielu prowadzonych obecnie badań jest wyjaśnienie genetycznych uwarunkowań tego zjawiska i znalezienie odpowiedzi na pytanie, czy nowe schematy leczenia astmy pomogą pokonać brak wrażliwości na glikokortykosteroidy.
Schwartz i wsp.3 jako pierwsi opisali oporność na glikokortykosteroidy w niewielkiej grupie chorych na astmę, która była źle kontrolowana. Obserwowano u nich odwracalność obturacji oskrzeli po podaniu wziewnych β-mimetyków, natomiast zastosowanie glikokortykosteroidów w dużych dawkach nie miało znaczącego wpływu na nasilenie skurczu oskrzeli. Istotne osłabienie odpowiedzi na glikokortykosteroidy widoczne było nawet w obrazie krwi; po podaniu leków tej grupy nie obserwowano istotnego zmniejszenia eozynofilii krwi obwodowej mimo wystąpienia ogólnoustrojowych cushingoidalnych działań niepożądanych glikokortykoterapii. W innym badaniu opisano podobną grupę 58 chorych, u których niezadowalającą odpowiedź na glikokortykosteroidy definiowano jako brak rozkurczu oskrzeli po zastosowaniu tych leków.4 W następnym okresie astmę oporną na glikokortykosteroidy zaczęto rozpoznawać, jeżeli po 14 dniach doustnego stosowania prednizolonu (40 mg/24h) nie obserwowano zwiększenia wyjściowej wartości natężonej objętości wydechowej pierwszosekundowej (FEV1) o więcej niż 15%, przy założeniu, że wziewne podanie β2-mimetyku – salbutamolu – powodowało wzrost FEV1 o więcej niż 15%.1 Jeżeli przyrost FEV1 wynosił ≥30%, rozpoznawano astmę wrażliwą na glikokortykosteroidy.1 Taką definicję oporności na glikokortykosteroidy wielokrotnie wykorzystywano w kolejnych badaniach. Chorzy z astmą oporną na te leki stanowią niezbyt liczną populację, która często pełni funkcję grupy porównawczej w wielu badaniach analizujących mechanizmy braku wrażliwości na glikokortykosteroidy w astmie.
Definicję astmy opornej na glikokortykosteroidy opracowano z uwzględnieniem jednego aspektu – odwracalności obturacji oskrzeli pod wpływem leków, nie wzięto natomiast pod uwagę cech klinicznych, charakteru astmy czy swoistych mechanizmów patofizjologicznych. W opisaniu tych zagadnień ogromną rolę odegrają przyszłe badania, w których będzie można wykorzystać opracowany niedawno Severe Asthma Research Protocol.5-7 W jednym z opracowań Carmichael i wsp.4 wykazali na przykład, że u chorych na astmę oporną na glikokortykosteroidy czas trwania choroby jest dłuższy (> 5 lat), częściej stwierdza się u nich rodzinne występowanie astmy, gorsze parametry czynnościowe układu oddechowego w godzinach rannych i bardziej nasiloną nieswoistą nadreaktywność oskrzeli. Część tych pacjentów choruje na astmę ciężką. Należy jednak pamiętać, że oporność na glikokortykosteroidy i ciężka astma nie są terminami, których można używać zamiennie, nie wszyscy bowiem chorzy z opornością na leki tej grupy spełniają jednocześnie kryteria astmy ciężkiej i odwrotnie – nie u wszystkich chorych na astmę ciężką obserwuje się brak reakcji na glikokortykosteroidy.6
Część cech patofizjologicznych chorych na astmę oporną na glikokortykosteroidy jest już dobrze poznana. Pogrubienie nabłonka dróg oddechowych i błony podstawnej u chorych na astmę oporną na leki tej grupy jest wyraźniejsze niż u chorych na astmę wrażliwą na glikokortykosteroidy, natomiast nasilenie złuszczania nabłonka dróg oddechowych jest w obydwu grupach podobne.8,9 Różnicom między obydwiema grupami towarzyszy zróżnicowanie ekspresji markerów proliferacji nabłonka, takich jak nasilenie ekspresji Ki67, zmniejszenie ekspresji białka retinoblastoma i Bcl-2 (negatywnego czynnika regulującego śmierć komórek nabłonka).8 Uważa się, że brak pobudzenia syntezy inhibitora metaloproteinazy-1 pod wpływem glikokortykosteroidów wziewnych u chorych na astmę oporną na te leki to jeden z mechanizmów odpowiedzialnych, przynajmniej częściowo, za nasilenie procesu przebudowy dróg oddechowych w tej grupie chorych.10
Do identyfikacji chorych na astmę steroidooporną wykorzystuje się też inne obiektywne i nieinwazyjne techniki badawcze. Analiza stężenia lotnych związków organicznych w powietrzu wydechowym może znaleźć zastosowanie w charakterystyce różnych fenotypów chorych na astmę z opornością na glikokortykosteroidy. Wyniki wstępnego badania przeprowadzonego w grupie 10 chorych na astmę ciężką w średnim wieku wykazały, że odrębne „ślady zapachowe” odróżniają pacjentów z tej grupy od grupy kontrolnej oraz w mniejszym stopniu od osób młodszych chorych na astmę łagodną.11 Do pełnej oceny skuteczności takiego podejścia konieczne jest przeprowadzenie dalszych badań z udziałem większych grup, dobrze dobranych pod względem wieku i ciężkości choroby.
W większości badań nad astmą z opornością na glikokortykosteroidy wzięło udział tylko kilku chorych (zazwyczaj 6-12) w każdej z badanych grup. Dokładną interpretację tych badań często utrudnia również to, że badacze nie podają zbyt wielu informacji na temat typu astmy, ograniczając się do wyjściowej wartości FEV1 przed doustnym podaniem prednizolonu.
Molekularne mechanizmy działania glikokortykosteroidów
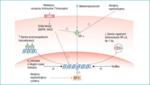
Rycina 1. Schemat wewnątrzkomórkowego działania glikokortykosteroidów i mechanizmów na nie wpływających
Glikokortykosteroidy działają po połączeniu się ze swoistymi cytoplazmatycznymi receptorami glikokortykosteroidowymi i ich aktywacji (ryc. 1). Kompleks glikokortykosteroid–receptor glikokortykosteroidowy przemieszcza się do jądra komórkowego, gdzie reguluje ekspresją genów.1 Efektem oddziaływania tych kompleksów może być aktywacja genów przeciwzapalnych wywołana bezpośrednim połączeniem z elementem odpowiadającym na glikokortykosteroid (GRE) znajdującym się w części promotorowej genu lub wybiórcza represja swoistych genów zapalnych wywołana pleotropowym oddziaływaniem na promotorowe fragmenty swoiste dla czynnika jądrowego κB oraz kompleks aktywacyjny białka aktywatorowego (AP)-1.1 Działania tego typu mają przede wszystkim charakter hamujący. Wydaje się więc, że u podstaw skuteczności glikokortykosteroidów leży pleotropowe działanie receptorów glikokortykosteroidowych, a nieprawidłowa aktywacja innych szlaków przesyłania informacji wewnątrzkomórkowej znoszących efekty pobudzenia receptorów glikokortykosteroidowych może mieć istotny wpływ na oporność na tę grupę leków.
Molekularne mechanizmy oporności na glikokortykosteroidy
Oporność na przeciwzapalne działanie glikokortykosteroidów na poziomie komórkowym może wynikać z wielu mechanizmów różniących się nieco u poszczególnych chorych. Zmniejszenie odpowiedzi na leki tej grupy widoczne w komórkach chorych na astmę próbuje się tłumaczyć zmniejszoną ekspresją receptorów glikokortykosteroidowych, osłabieniem ich zdolności do wiązania się z DNA lub nasiloną ekspresją czynników transkrypcyjnych (np. AP-1).1 Warto również pamiętać, że w przeciwieństwie do chorych z rodzinną opornością na glikokortykosteroidy, u których obserwuje się mutacje receptora glikokortykosteroidowego i zmianę stężenia kortyzolu w surowicy, wartość podstawowego stężenia kortyzolu we krwi u chorych z opornością na glikokortykosteroidy jest prawidłowa, nie wykazują oni również typowych cech choroby Addisona.1
Błędy w wiązaniu ligandu, translokacji jądrowej i łączeniu z kofaktorami
Niektóre cytokiny – szczególnie interleukiny IL-2, IL-4 i IL-13, których nadmierną ekspresję wykazano w bioptatach błony śluzowej chorych z astmą steroidooporną – mogą odpowiadać za zmniejszenie powinowactwa receptorów glikokortykosteroidowych w komórkach stanu zapalnego, takich jak limfocyty T, co może być przyczyną miejscowej oporności na przeciwzapalne działanie glikokortykosteroidów.1 Reakcje te zachodzą w jądrze komórkowym, a po uniemożliwieniu kontaktu tych komórek z krwią ulegają odwróceniu.1 Podobne zmiany w powinowactwie receptorów glikokortykosteroidowych obserwuje się również w pochodzących od osób uczulonych jednojądrzastych komórkach krwi obwodowej i eksponowanych w warunkach in vitro na alergeny kota.12 Wynika z tego, że zaburzenia powinowactwa receptora glikokortykosteroidowego odzwierciedlają typ zapalenia widoczny u chorych na astmę steroidooporną.1 Zaburzenia powinowactwa receptora oraz upośledzenie translokacji jądrowej mogą wynikać z nadmiernej ekspresji dominującej, nieaktywnej izoformy receptora glikokortykosteroidowego – GRβ. Wykazano, że u chorych na astmę steroidooporną GRβ może mieć istotny wpływ na funkcję GRα w komórkach uzyskiwanych podczas płukania oskrzelowo-pęcherzykowego. Dowodem na to są wyniki badań, w których aktywność GRβ wyłączano za pomocą krótkich interferujących sekwencji RNA.12 Opracowanie w ostatnim czasie liganda GRβ może mieć istotne zastosowanie terapeutyczne.13
Do utraty funkcji receptora glikokortykosteroidowego może doprowadzić jego fosforylacja wywołana aktywacją kinazy białkowej przez mitogen p-38 (MAPK – mitogen-activated protein kinase).14 W zależności od działającego bodźca również inne kinazy typu MAPK lub szlaki przesyłania sygnałów za pomocą kinaz (np. zewnątrzkomórkowa kinaza MAPK sterowana sygnałem, odgrywająca rolę w sytuacji pobudzenia limfocytów T w wyniku aktywacji koreceptora lub superantygenu) mogą regulować funkcję receptorów glikokortykosteroidowych.1 W tym drugim przypadku może być to wstęp do pobudzenia GRβ. W badaniach na myszach wykazano ponadto, że po stymulacji przez IL-2 czynnikiem regulującym reaktywność receptora glikokortykosteroidowego jest JAK3/STAT5 (Janus kinase3/Signal transducer and activator of transcription 5).12 Wydaje się, że może mieć to związek z nieprawidłową ekspresją SOCS (supressor of cytokine signaling) opisywaną u chorych na astmę oporną na glikokortykosteroidy.15 W tej grupie chorych terapia glikokortykosteroidami wziewnymi nie wpływa na podwyższone stężenie fosfotyrozyny związanej z czynnikiem wzrostu, co u chorych na astmę ciężką może prowadzić do rozwoju przewlekłego stanu zapalnego, w którym glikokortykosteroidy są nieskuteczne.16 Należy jednak zaznaczyć, że w wielu przypadkach dokładny mechanizm oddziaływania kinaz na aktywność receptorów glikokortykosteroidowych u chorych na astmę steroidooporną nie został w pełni poznany.1,17
U wielu chorych na astmę oporną na glikokortykosteroidy obserwuje się zaburzenia translokacji receptora glikokortykosteroidowego do jądra komórkowego,1 co może prowadzić do utraty zdolności tworzenia kompleksu GR-GRE DNA.1 Wykazano także, że duże stężenie tlenku azotu (NO), w wyniku nitrozylacji w miejscu interakcji z hsp90, może niekorzystnie wpływać na funkcję receptora glikokortykosteroidowego i zmieniać zdolność jego łączenia się z ligandem.1 Ten rodzaj interakcji może odgrywać dużą rolę u chorych na astmę oporną na glikokortykosteroidy, u których stężenie wydychanego tlenku azotu jest podwyższone.1,18