Wynik badania elektromiograficznego jest podobny jak w SMA. Ponadto w SBMA stwierdza się cechy uszkodzenia neurogennego z obecnością licznych fascykulacji w mięśniach regionu opuszki. Przewodnictwo czuciowe jest nieprawidłowe. Rejestruje się obniżone amplitudy odpowiedzi czuciowych z nerwów obwodowych.
SBMA wymaga różnicowania przede wszystkim z ALS. W ALS nie stwierdza się drżenia rąk, objawów czuciowych ani zaburzeń endokrynologicznych. Ponadto postęp choroby w ALS jest dużo szybszy. Rozpoznanie SBMA, podobnie jak SMA, ustalane jest na podstawie badania genetycznego.
Dziedziczne neuropatie ruchowe
Dziedziczne neuropatie ruchowe (dHMN – distal hereditary motor neuropathies) to bardzo rzadka i niezwykle heterogenna pod względem genetycznym i klinicznym grupa chorób dolnego neuronu ruchowego, które mogą być dziedziczone w sposób autosomalnie dominujący, autosomalnie recesywny lub sprzężony z chromosomem X. Dotychczas odkryto mutację kilkunastu genów odpowiedzialnych za rozwój choroby. Mutacja jednego genu może powodować różne fenotypy choroby. Szacuje się jednak, że w 80% przypadków dHMN są spowodowane mutacją jeszcze nieodkrytego genu. U większości chorych objawy rozwijają się w ciągu dwóch pierwszych dekad życia (tab. 5).

Tabela 5. Podział dziedzicznych neuropatii ruchowych (dHMN) w zależności od sposobu dziedziczenia, zidentyfikowanego genu i objawów klinicznych wg Hardinga, zmodyfikowany przez Rossora
Dziedziczne neuropatie ruchowe charakteryzują się powoli postępującym, symetrycznym i głównie dystalnym niedowładem kończyn dolnych, bez towarzyszących zaburzeń czucia. W dHMN nie występują objawy opuszkowe. Do rozwoju objawów dochodzi w dzieciństwie, a początek ich wystąpienia jest trudny do wychwycenia. Objawy zazwyczaj rozpoczynają się w obrębie stóp (stopa wydrążona, płaska, palce młotkowate), z czasem wstępują. Wyjątkiem jest typ V wg Hardinga, w którym pierwsze objawy rozwijają się w obrębie kończyn górnych.
Oprócz niedowładu kończyn w niektórych typach dHMN występują objawy towarzyszące, np. porażenie przepony lub porażenie strun głosowych (tab. 5).
Istotną rolę w diagnostyce dHMN odgrywa badanie elektrofizjologiczne, które pozwala różnicować tę grupę chorób z polineuropatiami ruchowo-czuciowymi uwarunkowanymi genetycznie (CMT – Charcot-Marie-Tooth disease) oraz z dystalnymi miopatiami. W badaniu przewodnictwa nerwowego stwierdza się obniżone amplitudy odpowiedzi ruchowych; zmiany są zależne od długości włókien. W przeciwieństwie do CMT przewodnictwo czuciowe jest prawidłowe. Badanie elektromiograficzne potwierdza przewlekle neurogenne uszkodzenie mięśni dystalnych.
Rozpoznanie choroby ustala się na podstawie obrazu klinicznego, wyniku badania elektrofizjologicznego i wyniku badania genetycznego.
Dziedziczne paraparezy spastyczne
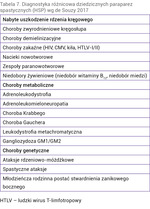
Dziedziczne paraparezy spastyczne (HSP – hereditary spastic paraplegia) to grupa chorób, w przebiegu których dochodzi do uszkodzenia górnego neuronu ruchowego. Stanowią heterogenną grupę schorzeń, które mogą być dziedziczone w sposób autosomalnie dominujący, autosomalnie recesywny, sprzężony z chromosomem X lub mitochondrialnie. Opisywane są również przypadki sporadyczne. Dotychczas odkryto ponad 70 genów odpowiedzialnych za rozwój choroby (tab. 6).
HSP występują rzadko. Chorobowość wynosi 1,8/100 000. Choroba postępuje powoli. Paraparezy spastyczne dziedziczone w sposób autosomalnie dominujący rozwijają się zazwyczaj w wieku dorosłym (między drugą a trzecią dekadą życia), a dziedziczone w sposób autosomalnie recesywny – w dzieciństwie lub u młodych dorosłych.
Głównym objawem HSP jest spastyczny niedowład kończyn dolnych, który wynika z uszkodzenia dróg korowo-rdzeniowych. Mogą mu towarzyszyć zaburzenia zwieraczowe lub czucia głębokiego.
HSP dzielimy na formy proste i złożone. W przypadku tych pierwszych niedowład jest jedynym objawem choroby. W przypadku współistniejącego zajęcia innych układów paraparezę spastyczną określamy jako złożoną. W formie złożonej HSP może dochodzić do zajęcia móżdżku, układu pozapiramidowego, nerwów obwodowych lub mięśni. W tej grupie chorych mogą występować także zaburzenia funkcji poznawczych lub psychiczne. Niekiedy u chorych występują cechy dysmorfii (zmiany w obrębie twarzy, niski wzrost), malformacje kostne (skolioza, malformacje w obrębie stóp) lub zajęcie układu wzrokowego (zaćma, zwyrodnienie barwnikowe siatkówki, zanik nerwu wzrokowego). W badaniach obrazowych chorych na HSP złożoną stwierdza się nieprawidłowości takie jak zmiany w obrębie istoty białej mózgu, ścieńczenie ciała modzelowatego, zanik rdzenia kręgowego lub móżdżku.
Klasyfikacje HSP uwzględniają sposób dziedziczenia, formę choroby (prosta lub złożona) lub zmutowany gen (SPG – spastic paraplegia genes).