Zablokowanie jodochwytności pozostawionego resztkowego utkania tarczycy i ewentualnych mikro- oraz makroprzerzutów raka (fot. 7) na okres dwóch-trzech miesięcy.
Komentarz
Całkowite wycięcie gruczołu tarczowego z powodu zróżnicowanego raka tarczycy w większości przypadków wymaga uzupełniającego leczenia jodem promieniotwórczym 131I. Celem leczenia jodem promieniotwórczym jest zniszczenie resztkowego utkania tarczycy oraz mikroprzerzutów i makroprzerzutów raka. W wielu ośrodkach leczenie jodem promieniotwórczym poprzedzane jest badaniami diagnostycznymi (w tym scyntygrafią z zastosowaniem jodu 131I), które pozwalają określić objętość pozostawionego utkania tarczycy oraz ewentualne występowanie i lokalizację jodochwytnych przerzutów raka. W zależności od wyników powyższych badań ustalane są cele leczenia (radykalny lub paliatywny) oraz optymalna aktywność lecznicza jodu promieniotwórczego – w terapii stosuje się jod promieniotwórczy 131I o aktywności 30-200 mCi (1,11-7,4 GBq).
Tomografię komputerową z kontrastem można bez przeszkód wykonać po leczeniu jodem promieniotwórczym. Przeprowadzenie tego badania bezpośrednio po zabiegu operacyjnym lub na krótko przed nim opóźnia możliwość skutecznego leczenia uzupełniającego.
W wątpliwych przypadkach można sprawdzić zawartość jodu w moczu pacjenta.
Stężenie jodu > 150 mcg/dl oznacza, że leczenie jodem promieniotwórczym należy odłożyć.
Przypadek piąty
Do poradni zgłasza się 22-letnia pacjentka kierowana po operacji z powodu raka brodawkowatego tarczycy podejrzewanego na podstawie BACC guzka tarczycy (kategoria 5). Całkowite wycięcie tarczycy przeprowadzono siedem tygodni wcześniej. Przez pierwsze cztery tygodnie pacjentka oczekiwała na wynik badania histopatologicznego, następnie zapisała się do poradni w Centrum Onkologii. Na wizytę oczekiwała trzy tygodnie.
W związku z przedoperacyjnym podejrzeniem raka tarczycy i mając na uwadze, że pacjentka będzie wymagała leczenia jodem promieniotwórczym, którego skuteczność warunkowana jest osiągnięciem poziomu TSH > 35 mIU/l, pacjentce po operacji nie zalecono stosowania L-T4.
Podczas badania w poradni u chorej stwierdzono kliniczne cechy niedoczynności tarczycy, a stężenie TSH wynosiło 180 mIU/l.
Błędne przekonanie
Niewprowadzenie leczenia L-T4 od razu po operacji stworzy optymalne warunki do leczenia i zmotywuje lekarza do pilnej terapii.
Skutek
Narażenie chorej na długotrwałą głęboką niedoczynność tarczycy.
Komentarz
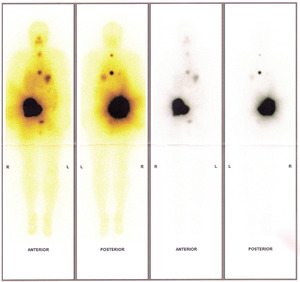
Fot. 8. Scyntygrafia poterapeutyczna całego ciała u pacjentki, u której raka pęcherzykowego tarczycy rozpoznano na podstawie biopsji cienkoigłowej przerzutu w lewej kości biodrowej. Chora po operacji całkowitego wycięcia tarczycy i po kolejnym leczeniu jodem promieniotwórczym 131I. Mimo całkowitego wycięcia tarczycy i przebytego dwukrotnie leczenia jodem promieniotwórczym, u pacjentki miesiąc po odstawieniu L-T4 nie stwierdza się hipotyreozy (TSH 3,0 mIU/l). Uwidoczniło się ogniskowe gromadzenie izotopu w obrębie mostka, kręgosłupa piersiowego, żeber lewych oraz lewej kości biodrowej. Jednolite gromadzenie jodu promieniotwórczego w wątrobie ma charakter fizjologiczny.
U chorych po całkowitym wycięciu tarczycy z powodu raka gruczołu tarczowego warunkiem miarodajnej scyntygrafii diagnostycznej i leczenia jodem 131I jest wzrost stężenia TSH powyżej 35 mIU/l. Odstępstwem od tej reguły jest rzadko spotykana tyreotoksykoza spowodowana funkcjonującymi autonomicznie przerzutami raka tarczycy (fot. 8). Wzrost stężenia TSH można uzyskać, odstawiając na około cztery tygodnie L-T4 (tzw. stymulacja endogenną tyreotropiną) lub stosując rekombinowaną ludzką tyreoglobulinę (rhTSH). Ze względu na relatywnie wysokie koszty stosowania rhTSH, u większości chorych stosuje się stymulację endogenną tyreotropiną.
Jeśli pacjent przed operacją był w eutyreozie, już nazajutrz po operacji można włączyć pełną dawkę substytucyjną L-T4, na ogół 75-125 mcg dziennie (najlepiej, gdy dawkę ustali endokrynolog). Odstąpienie od stosowania terapii substytucyjnej byłoby wskazane w warunkach pełnej dostępności terapii izotopowej. W dobie ograniczenia nakładów na lecznictwo i wydłużenia czasu oczekiwania na to świadczenie, postępowanie takie nie jest uzasadnione. Odstawienie L-T4 bez wyznaczenia terminu terapii izotopowej wydłuża okres pozostawania chorego w głębokiej hipotyreozie. Ten stan metaboliczny bardzo niekorzystnie wpływa na jakość życia pacjenta, nasila objawy innych chorób (depresji, zaburzeń przewodzenia bodźców w sercu, niewydolności krążenia) i może zmienić siłę działania oraz farmakokinetykę leków, np. o działaniu sedatywnym lub o działaniu chrono- i inotropowym ujemnym. Z tego względu decyzja o rozpoczęciu stymulacji endogenną tyreotropiną powinna zostać podjęta w uzgodnieniu z odpowiednim oddziałem terapii jodem promieniotwórczym, po wyznaczeniu terminu terapii uzupełniającej.