Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Choroby naczyń
dr hab. n. med. Tomasz Urbanek, Katedra i Klinika Chirurgii Ogólnej i Naczyń SUM, Katowice
Zwężenia miażdżycowe tętnic szyjnych i nerkowych u pacjentów z chorobą wieńcową – obrazowanie, wskazania do leczenia interwencyjnego oraz wyniki bezpośrednie i odległe zabiegów
Anna Kabłak-Ziembicka, Tadeusz Przewłocki, Daniel Rzeźnik, Piotr Pieniążek, Leszek Wrotniak, Piotr Podolec
Wprowadzenie
Częstość występowania zmian miażdżycowych wzrasta z wiekiem, a blaszki miażdżycowe stwierdza się u 10% mężczyzn w wieku 40 lat oraz u 80% w 60 roku życia [1]. Rozwój zmian miażdżycowych zależy od wielu czynników niemodyfikowalnych, takich jak uwarunkowania genetyczne, płeć, wiek, jednak przede wszystkim na progresję miażdżycy wpływają czynniki środowiskowe, których wyróżniono kilkadziesiąt, a do najważniejszych z nich należą: palenie tytoniu, cukrzyca, nawyki żywieniowe i nadciśnienie. W ostatnich latach wykazano także wiodącą rolę procesów zapalnych [2].
Do podstawowych manifestacji klinicznych miażdżycy należą: nagły zgon sercowo-naczyniowy (cardiovascular death, CVD), zawał mięśnia sercowego (myocardial infarction, MI), udar niedokrwienny mózgu (ischemic stroke, IS), chromanie przestankowe oraz również nierzadko niewydolność nerek (renal insufficiency, RI). Wobec wydłużania się średniej życia i starzenia się społeczeństw zwraca uwagę wieloogniskowość zaawansowanych zmian miażdżycowych [3-6]. Wśród chorych leczonych z powodu choroby wieńcowej (coronary artery disease, CAD) aż u 10-20% z nich występuje zwężenie tętnicy szyjnej wewnętrznej ≥50% (internal carotid artery stenosis, ICAS), u 20-40% miażdżyca zarostowa tętnic kończyn dolnych (peripheral artery occlusive disease, PAOD), a u 6-18% zwężenie tętnicy nerkowej ≥50% (renal artery stenosis, RAS) [3-6]. Podsumowując, co trzeci chory z istotną CAD ma ≥50% zwężenie tętnic innych niż wieńcowe [7,8].
Wielopoziomowość zwężeń miażdżycowych przyczynia się do częstszego występowania zdarzeń sercowo-naczyniowych (cardiovascular event, CVE). W badaniu populacyjnym Reduction of Atherotrombosis for Continued Health (REACH Registry) w obserwacji rocznej CVE (CVD, MI, IS lub hospitalizacja z przyczyn sercowo-naczyniowych) wystąpiły u 12,6% chorych z miażdżycą ograniczoną do jednego obszaru, u 21,1% chorych z miażdżycą w dwóch obszarach oraz u 26,3% chorych z CAD, PAOD i ICAS [9]. W badaniu autorów 2-letnie przeżycie wolne od CVE (CVD, MI, IS lub objawowa progresja miażdżycy) wśród 527 chorych poddanych rewaskularyzacji ze zwężeniami w jednym, dwóch, trzech i czerech obszarach tętniczych wyniosło odpowiednio: 93, 85, 75 i 59% [10]. Wielopoziomowość zmian pogarsza również wyniki rewaskularyzacyjnych zabiegów przezskórnych i chirurgicznych w danym obszarze tętniczym i zwiększa częstość powikłań okołozabiegowych [10-12].
Pełna rewaskularyzacja w obrębie wszystkich obszarów tętniczych ze zwężeniem tętnicy jest rzadko możliwa, a często brakuje także wskazań klinicznych do takiego postępowania. Niezależnie od zakresu wykonanych rewaskularyzacji obowiązuje indywidualna ścisła i intensywna farmakologiczna interwencja oraz modyfikacja stylu życia dla uzyskania kontroli czynników ryzyka miażdżycy i spowolnienia tempa progresji zmian miażdżycowych [13].
W artykule autorzy przedstawiają krótki przegląd obrazowych metod diagnostycznych, obecnie obowiązujące wskazania do leczenia interwencyjnego oraz wyniki bezpośrednie i odległe zabiegów rewaskularyzacji tętnic szyjnych i nerkowych, jak również istniejące wciąż wątpliwości związane z samym zabiegiem u chorych ze współistniejącą chorobą niedokrwienną serca.
Diagnostyka zwężenia tętnicy szyjnej wewnętrznej
Zgodnie z obowiązującymi standardami Europejskiego Towarzystwa Kardiologicznego (ESC) badanie obrazowe w kierunku oceny tętnicy szyjnej wewnętrznej u chorych z CAD powinno być wykonane u osób, u których w ostatnich 6 miesiącach doszło do udaru niedokrwiennego mózgu lub epizodu TIA [13].
W wielu ośrodkach, w tym autorów, badanie USG tętnic domózgowych wykonywane jest rutynowo u chorych przygotowywanych do operacji pomostowania aortalno-wieńcowego (CABG), uzupełniając tym samym badanie fizykalne [4,5]. Jest to spowodowane faktem, że ICAS ≥80% zwiększa blisko 10-krotnie ryzyko okołooperacyjnego udaru mózgu w czasie CABG (nawet do 20%), również wśród chorych dotychczas bez objawów neurologicznych [13,14]. Wyniki tych badań znalazły swoje odzwierciedlenie w algorytmach (m.in. skala EuroSCORE) stratyfikujących okołozabiegowe ryzyko zgonu u chorych kierowanych do CABG [15].
Rozpoznanie zwężenia tętnicy szyjnej wewnętrznej umożliwia obniżenie tego ryzyka przez wykonanie rewaskularyzacji w obu tych obszarach. W tym celu przeprowadza się angioplastykę z implantacją stentu (carotid artery stenting, CAS) do ICAS przed CABG (zabiegi hybrydowe) albo jednoczasowe lub 2-etapowe leczenie chirurgiczne obu tych schorzeń w oparciu o analizę ryzyka okołozabiegowego u danego chorego, warunki anatomiczne zwężeń i możliwości techniczne wykonania zabiegów [14,16,17].
Badanie ultrasonograficzne powinno być ponadto wykonane u każdego chorego ze stwierdzanym szmerem nad tętnicą szyjną.
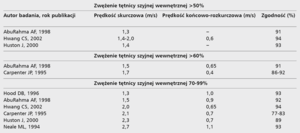
Standardem diagnostycznym dla tętnic dogłowowych są: ultrasonograficzne badanie doppler duplex tętnic szyjnych i kręgowych (klasa zaleceń I/A), angiografia metodą tomografii komputerowej lub rezonansu magnetycznego (klasa zaleceń I/A) [13]. Czułość i swoistość tych metod diagnostycznych w poprawnym rozpoznaniu stopnia ICAS sięga 95-100% w akredytowanych, certyfikowanych ośrodkach.
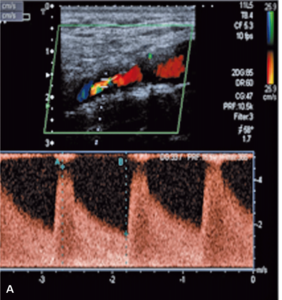
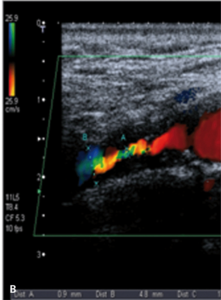
Badanie ultrasonograficzne doppler duplex tętnic szyjnych i ocena koła Willisa
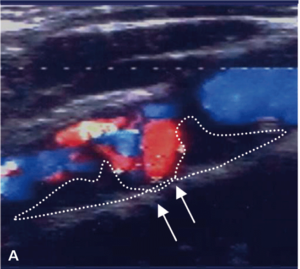
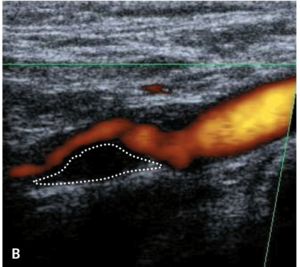
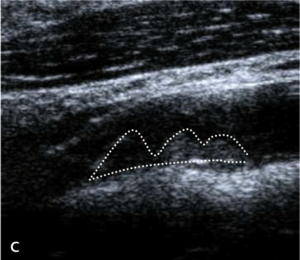
Badaniem ultrasonograficznym można uwidocznić zwężenie i ocenić jego morfologię.
Morfologia zmiany miażdżycowej nie stanowi według standardów kryterium kwalifikacyjnego do rewaskularyzacji, ale wykazuje silny związek z ryzykiem udaru niedokrwiennego mózgu zarówno u chorych leczonych zachowawczo, jak i okołozabiegowego IS w czasie rewaskularyzacji [18].
Zmiany hipoechogeniczne to zmiany częściej lipidowe lub skrzepliny, zmiany izoechogeniczne to zmiany włókniste, a zmiany hiperechogeniczne zawierają zwapnienia.
Zmiany hipoechogeniczne (skrzeplina, lipidowa) są związane z dużym ryzykiem IS zarówno u chorych dotychczas bezobjawowych, jak i w trakcie CAS czy endarterektomii (carotid endarterectomy, CEA), bo łatwo je uruchomić i rozkruszyć, powodując zatory do tętnic mózgowych [18].