Według światowych rejestrów oraz doświadczeń ośrodka autorów do typowych poważnych powikłań CAS zalicza się: zgon (0,5-1%), MI (0,3-0,7%), duży IS (2%) lub mały IS (3,8%) w przebiegu zatoru fragmentami blaszki do tętnic mózgowych, zespół hiperperfuzji (z krwawieniem wewnątrzczaszkowym lub bez niego; 0,6%), dyssekcję tętnicy szyjnej (0,4%), perforację CCA/ICA (0,1%), przemijającą hipotonię lub bradykardię (9%). Inne powikłania obejmują: nefropatię pokontrastową, zatorowość cholesterolową oraz komplikacje związane z miejscem wkłucia (krwiak w pachwinie – 3%, tętniak rzekomy, przetoka tętniczo-żylna, niedokrwienie kończyny dolnej związane z dyssekcją tętnicy biodrowej lub udowej, niedokrwistość wymagająca transfuzji krwi) [28,29]. Dotychczasowe metaanalizy wykazują, że CEA w porównaniu z CAS zabezpiecza bardziej przed okołozabiegowym IS, natomiast CAS bardziej chroni przed MI i uszkodzeniem nerwów czaszkowych.
W wyniku prowadzonych od wielu lat badań Cremonesi i wsp. oraz Pieniążek i wsp. niezależnie od siebie zaproponowali algorytmy tzw. tailored-CAS – strategii indywidualnego doboru stentów i systemów neuroprotekcji mózgowej w oparciu o analizę anatomii zwężenia, morfologii blaszki miażdżycowej i stopnia zwężenia ICAS, ocenę przeciwstronnej CCA i ICA oraz ocenę krążenia mózgowego, aby minimalizować ryzyko powikłań okołozabiegowych CAS [29,30]. Dla zmian wysokiego ryzyka (ciasnych, miękkich, ze skrzepliną) oraz u chorych z objawowami preferencyjnie stosuje się systemy neuroprotekcji proksymalnej oraz stenty zamkniętokomórkowe [30]. W badaniu Pieniążka i wsp. spowodowało to obniżenie liczby poważnych powikłań okołozabiegowych CAS w obserwacji 30-dniowej (zgon, każdy IS, MI) do 3,6% w grupie 557 chorych z objawowym neurologicznie zwężeniem tętnicy szyjnej wewnętrznej oraz do 1,5% w grupie 524 chorych bez objawów [30].
Po CAS obowiązuje podwójna terapia przeciwpłytkowa kwasem acetylosalicylowym (ASA, w dawce 75 mg na dobę) i klopidogrelem (75 mg na dobę) przez 1-3 miesiące, następnie ASA 75 mg przewlekle [13]. Przy braku tolerancji klopidogrelu można zastąpić go tiklopidyną w dawce 250 mg podawanej 2 razy dziennie. Wartość nowych leków przeciwpłytkowych, tj. prasugrelu i tikagreloru, nie została dotąd określona.
Niedawno opublikowane wyniki badania CREST wykazały podobny odsetek powikłań okołozabiegowych CAS i CEA, co spowodowało, że amerykańskie FDA zdecydowało się zaakceptować u chorych z ciasnym zwężeniem tętnicy szyjnej wewnętrznej CAS z rutynowym zastosowaniem systemu protekcji mózgowej jako metodę alternatywną dla CEA (klasa zaleceń I/B dla chorych objawowych, IIb dla bezobjawowych) [24,31].
Zalecenia ESC w tym zakresie są nieco ostrożniejsze, rekomendując CAS jako alternatywę dla CEA u chorych objawowych w dużych ośrodkach, w których okołozabiegowe ryzyko zgonu lub udaru mózgu wynosi <6% (klasa zaleceń IIb/B) [13].
U chorych po zabiegu operacyjnym lub przezskórnym należy wykonać badanie USG tętnic dogłowowych w ciągu kilku dni po zabiegu, a następnie po 6 i 12 miesiącach w celu wczesnego wykrycia ewentualnej restenozy. Uzasadnione wydaje się także coroczne powtarzanie badania w ramach monitorowania progresji zmian miażdżycowych w innych tętnicach dogłowowych.
Wyniki odległe stentowania tętnicy szyjnej wewnętrznej
Dotychczas opracowano kilka rejestrów zawierających kilkuletnią obserwację chorych poddanych CAS [32,33]. Największy światowy rejestr Wholeya i wsp. raportuje ryzyko udaru niedokrwiennego mózgu wynoszące 1,3, 1,3 i 1,7 % w odpowiednio 1-, 2- i 3-letniej obserwacji po CAS [32]. Roubin i wsp. w 5-letniej obserwacji po CAS podają wystąpienie IS u 3,2 % chorych [33]. Przeżycie odległe determinuje w tych grupach chorych głównie współistnienie CAD i występowanie incydentów kardiologicznych.
Rewaskularyzacja tętnicy szyjnej wewnętrznej a ocena funkcji poznawczych pacjenta
W czasie zabiegów CEA lub CAS nierzadko dochodzi do niemej klinicznie mikrozatorowości mózgowej, z czego 60-70% ognisk znika, a 30-40% z nich transformuje do pełnych ognisk niedokrwiennych w 6-miesięcznej obserwacji po zabiegu w kontrolnych badaniach MR [34,35].
Wiąże się to z kolejnym, dyskutowanym ostatnio, problemem pogorszenia funkcji poznawczych u pacjentów poddanych CEA lub CAS [36]. Na przykład w badaniu Gossetti i wsp. u 36% chorych poddanych CAS stwierdzono pogorszenie funkcji poznawczych, a w badaniu Bonati i wsp. u 17% po CEA [21,35]. Pojawiły się również w dostępnym piśmiennictwie doniesienia, że mikrozatorowość w trakcie zabiegów rewaskularyzacji ICAS może przyspieszać rozwój otępienia [37].
Dotychczas opublikowano na ten temat kilka doniesień, nie były one jednak prowadzone według zasad medycyny opartej na dowodach naukowych (evidence based medicine, EBM). Badania te wymagają standaryzacji testów psychoneurologicznych w celu uzyskania precyzyjnej oceny funkcji kognitywnych chorych przed zabiegami na ICA i po tych operacjach, a także zbadania ich potencjalnego związku z jakością życia chorych po CAS i CEA.
Diagnostyka nadciśnienia nerkowo-naczyniowego
Zwężenie tętnicy nerkowej jest najczęstszą przyczyną nadciśnienia wtórnego i najczęściej spowodowane jest miażdżycą. W populacji ogólnej jego częstość nie przekracza 1%, ale wśród chorych z nadciśnieniem tętniczym częstość RAS ocenia się na 3-5%. Ponadto RAS ≥50% stwierdza się u 6-18% chorych z chorobą wieńcową i u 22-59% chorych z miażdżycą zarostową tętnic kończyn dolnych [6,7,9,10]. Współwystępowanie RAS i ICAS oszacowano na 10-19%.
Rozpowszechnienie RAS wzrasta z wiekiem i w populacji osób powyżej 65 r.ż. częstość jego występowania szacuje się na około 7%. Postępowi choroby towarzyszy postępujące upośledzenie funkcji nerek z systematycznym wzrostem stężenia kreatyniny w surowicy krwi, a także gorsza kontrola nadciśnienia tętniczego ze wzrostem zapotrzebowania na leki hipotensyjne.
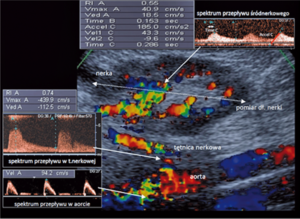
Rycina 3. Ocena zwężenia tętnicy nerkowej: obrazowanie aorty, tętnicy nerkowej oraz przepływów śródnerkowych w badaniu USG doppler duplex.
Zgodnie z obowiązującymi standardami ESC z 2011 r. nadciśnienie nerkowo-naczyniowe należy podejrzewać w sytuacjach klinicznych wymienionych w tabeli 4 [13].
Standardem diagnostycznym dla rozpoznania RAS są ultrasonograficzne badanie doppler duplex (klasa zaleceń I/B), angiografia metodą tomografii komputerowej lub rezonansu magnetycznego (klasa zaleceń I/B) [13]. Nie rekomenduje się rutynowego wykonania scyntygraficznej próby kaptoprilowej do diagnostyki RAS (klasa III/B). Klasyczna angiografia (klasa zaleceń I/C) zalecana jest u chorych z dużym prawdopodobieństwem RAS oraz u osób, u których wyniki badań nieinwazyjnych są niejednoznacze i nie rozstrzygają o stopniu RAS [13].

