Dodatkowe badania, takie jak tomografia komputerowa klatki piersiowej czy obrazowanie za pomocą rezonansu magnetycznego, nie są rutynowo wykorzystywane do diagnozowania tamponady serca. Po stabilizacji klinicznej pacjenta bywają przydatne w diagnostyce uzupełniającej do oceny lokalizacji wysięku, np. otorbionych zbiorników płynowych, charakterystyki płynu (wysiękowy, krwisty) czy rozpoznania patologicznych mas w obrębie klatki piersiowej (guzy, węzły chłonne, zmiany w miąższu płucnym) mogących być przyczyną płynu w osierdziu (ryc. 5).
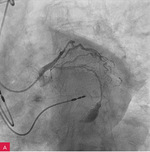
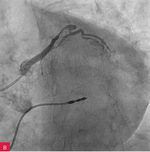
Rycina 6A i B. Perforacja tętnicy wieńcowej w związku z przezskórną interwencją wieńcową (PCI) u 94-letniej kobiety – rekanalizacja gałęzi okalającej (A). Założenie stentgraftu od pnia w kierunku gałęzi przedniej zstępującej, a następnie przezskórna perikardiocenteza z drenażem worka osierdziowego utrzymanym przez 3 dni (B). Wypis po 9 dniach
Leczenie
Leczenie tamponady serca można podzielić ze względów praktycznych na przyczynowe i objawowe. W każdym przypadku wystąpienia tego groźnego stanu klinicznego należy szukać przyczyny i/lub choroby, która do niego doprowadziła – aby jak najwcześniej wdrożyć interwencje terapeutyczne, np. założenie stentgraftu w przypadku perforacji naczynia podczas przezskórnej interwencji wieńcowej (PCI – percutaneous coronary intervention; ryc. 6A i B) lub leczenie operacyjne, gdy pęka wolna ściana lewej komory w zawale serca (ryc. 4). Leczenie objawowe tamponady jest prawie zawsze zabiegowe. Zabieg ratujący życie stanowi w tym przypadku perikardiocenteza przezskórna lub (jeżeli pozwala na to czas) – chirurgiczna.
Pierwszy opis odbarczenia serca pochodzi z 1653 r. – francuski anatom Riolan sugerował „trepanację mostkową” w celu obniżenia ciśnienia osierdziowego14. W 1911 r. paryski pediatra Antoine Bernard-Jean Marfan opisał metodę nakłucia worka osierdziowego z dostępu podmostkowego (obecnie nazywanego także dostępem podżebrowym lewym), która była stosowana przez następne dekady. Poprawę skuteczności, a przede wszystkim bezpieczeństwa perikardiocentezy, umożliwiły kolejno: fluoroskopia, elektrokardiografia i wreszcie – echokardiografia15.
Wskazania do perikardiocentezy
Można wyróżnić 3 grupy zastosowań/wskazań do nakłucia worka osierdziowego, które często się nakładają:
- Wskazanie lecznicze – odbarczenie i ratowanie życia, które jest obligatoryjne w każdym przypadku niestabilności hemodynamicznej, a także tzw. zagrażającej tamponady – gdy pojawiają się jej objawy echokardiograficzne, ale brak objawów klinicznych lub są one słabo wyrażone (ryc. 7).
- Wskazanie diagnostyczne – poszukiwanie przyczyn: najczęściej badanie cytologiczne, biochemiczne i mikrobiologiczne, w szczególności przy podejrzeniu gruźlicy, etiologii bakteryjnej lub nowotworowej.
- Wskazanie uzupełniające do leczenia podstawowego – szczególnie w onkologii. Wskazaniem do perikardiocentezy jest także duża ilość płynu w osierdziu (>20 mm) utrzymująca się powyżej 3 miesięcy pomimo leczenia farmakologicznego16.
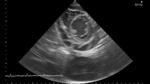
Rycina 7. Zagrażająca tamponada w przebiegu infekcyjnego zapalenia wsierdzia i wstrząsu septycznego o etiologii gronkowcowej u 28-letniej kobiety z jadłowstrętem psychicznym i skrajnym wyniszczeniem przy przyjęciu (chora leżąca). Liczne komory płynowe w osierdziu, widoczna także duża ilość płynu w lewej jamie opłucnej. Kompleksowe kilkumiesięczne leczenie farmakologiczne, łącznie z pobytem na oddziale intensywnej opieki medycznej i żywieniem pozajelitowym z dobrym efektem; następnie przekazanie pacjentki do Instytutu Psychiatrii. Obecnie (prawie 4 lata po chorobie) w dobrym stanie, aktywna zawodowo
Przeciwwskazania do perikardiocentezy
Nie ma ściśle określonych przeciwwskazań bezwzględnych, jedynie 3 względne:
- tamponada związana z tętniakiem rozwarstwiającym aorty
- krwiak worka osierdziowego w następstwie mechanicznych powikłań zawału serca takich jak pęknięcie wolnej ściany mięśnia sercowego (ryc. 4)
- rana kłuta lub postrzałowa serca.
Jednak nawet w tak dramatycznych scenariuszach klinicznych mogą istnieć chorzy, którzy odniosą korzyść z kontrolowanego nakłucia i jeszcze bardziej kontrolowanego odbarczania osierdzia – szczególnie gdy w echokardiografii obserwuje się prawie całkowite upośledzenie napełniania jam prawego serca z rozwiniętym wstrząsem kardiogennym i brakiem możliwości szybkiej interwencji chirurgicznej. Wówczas drenaż nawet niewielkiej ilości płynu może ustabilizować stan kliniczny i pozwolić na transport chorego do ośrodka kardiochirurgicznego. Jest to tzw. nakłucie pomostowe, dzięki któremu zwiększa się szansę na dalsze leczenie przyczynowe danego pacjenta.
Pomimo komplikacji wynoszących do 4%14 staranne zaplanowanie zabiegu ze wsparciem echokardiograficznym i szczególnym uwzględnieniem punktu wejścia czyni go stosunkowo bezpiecznym i możliwym do wykonania przy łóżku chorego przez każdego lekarza dyżurującego, który będzie mierzył się z tym problemem.
Technika perikardiocentezy
Jeśli nie ma bezpośredniego zagrożenia życia, należy przygotować chorego tak jak do małego zabiegu operacyjnego17: oznaczyć grupę krwi, ocenić morfologię krwi, parametry układu krzepnięcia, jonogram, równowagę kwasowo-zasadową i podstawowe parametry biochemiczne15. Obecnie zalecaną techniką przezskórną jest technika nadzorowana echokardiograficznie14, wprowadzona w 1979 r. w Mayo Clinic i rozpowszechniona na całym świecie. Staranne wybranie miejsca nakłucia oraz kierunku wprowadzenia igły jest albo poprzedzone TTE, albo wykonywane jednocześnie z echokardiografią w możliwie najdogodniejszych i najbezpieczniejszych pozycjach. Najpowszechniej wykorzystywanymi dojściami są: podżebrowe lewe (inaczej podmostkowe), koniuszkowe oraz przymostkowe (ryc. 8). Wybór miejsca wkłucia jest determinowany najlepszą dostępnością płynu, a także bezpieczeństwem. Należy pamiętać o wadach i zaletach każdej z dróg (patrz poniżej – powikłania perikardiocentezy).
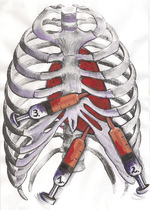
Rycina 8. Schemat najczęstszych dostępów wykorzystywanych do perikardiocentezy: 1) podżebrowy lewostronny, inaczej podmostkowy; 2) koniuszkowy; 3) przymostkowy (rys. S. Sowiński)
Pod kontrolą echokardiograficzną (przy łóżku chorego) lub fluoroskopową (w pracowni cewnikowania serca) należy wprowadzić igłę. Proksymalny koniec igły można połączyć kablem z jałowym krokodylkiem z elektrodą odprowadzenia (II) EKG – uniesienie ST świadczy o tym, że igła dotyka mięśnia sercowego i należy ją cofnąć (metoda mniej rozpowszechniona). Igłę do cewnikowania dużych naczyń wprowadza się połączoną ze strzykawką, stale aspirując. Jeśli planuje się drenaż, po uzyskaniu płynu wprowadza się przez igłę prowadnicę, następnie usuwa się samą igłę i po uprzednim rozszerzeniu – wprowadza się cewnik po prowadnicy oraz usuwa prowadnicę; końcówkę cewnika można zabezpieczyć kranikiem trójdrożnym. Wprowadzany po prowadnicy cewnik można wcześniej przygotować skalpelem, wycinając kilka niewielkich otworów na całej długości cewnika, co znacznie poprawia skuteczność drenażu (modyfikacja własna autorów). Płyn zaleca się drenować stopniowo – pod kontrolą echokardiograficzną – tak aby uniknąć rozstrzeni prawej komory. Dren można usunąć, gdy objętość dobowa ewakuowanego płynu jest mniejsza niż 30 ml14,18. Po usunięciu drenu zaleca się wykonanie RTG klatki piersiowej w celu wykluczenia odmy opłucnowej. Rola leczenia uzupełniającego jest bardzo ograniczona. Można zastosować ostrożnie płynoterapię (250-500 ml roztworu soli fizjologicznej) i/lub aminy presyjne (najlepiej dobutaminę), oczekując nieznacznej poprawy hemodynamicznej. Trzeba jednak pamiętać, że takie interwencje prowadzone bez kontroli (bez warunków intensywnego nadzoru kardiologicznego) mogą doprowadzić do pogorszenia i tak już złej sytuacji klinicznej14.