Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Mechaniczne wspomaganie krążenia

Rycina 2. Częstość incydentów w okresie obserwacji wewnątrzszpitalnej badania IABP-SHOCK II u pacjentów ze wspomaganiem i bez wspomagania kontrapulsacją wewnątrzaortalną (IABP) w trakcie zabiegu angioplastyki wieńcowej12
Jeszcze do niedawna szerokie zastosowanie w terapii wstrząsu kardiogennego znajdowała kontrapulsacja wewnątrzaortalna (IABP – intra-aortic balloon pump). Pozwala ona na niewielkie zwiększenie rzutu serca o 0,5-1,0 l/min, przy czym jej działanie może być mniej efektywne u pacjentów z tachykardią lub niemiarowością rytmu serca. W badaniu IABP-SHOCK II wykazano jednak, że jej rutynowe zastosowanie u pacjentów z AMI powikłanym wstrząsem kardiogennym nie niesie za sobą dodatkowych korzyści w okresie obserwacji krótko- i długoterminowej (ryc. 2)12. Brak istotnego wpływu IABP na śmiertelność w tej grupie chorych wykazano również w dużej metaanalizie 12 badań randomizowanych i 15 rejestrów badających to zagadnienie2. Tym samym aktualne wytyczne nie zalecają rutynowego użycia IABP (III B) u pacjentów z AMI powikłanym wstrząsem kardiogennym. Jej użycie można natomiast rozważać w przypadku wystąpienia powikłań mechanicznych AMI lub gdy zastosowanie IABP traktowane jest jako leczenie pomostowe do innego rodzaju wspomagania mechanicznego krążenia/transplantacji serca (klasa IIb C)3.
Coraz większe nadzieje wiąże się z zastosowaniem czasowego mechanicznego wspomagania krążenia u pacjentów ze wstrząsem kardiogennym – z użyciem pomp lub tętniczo-żylnej pozaustrojowej oksygenacji membranowej (VA-ECMO – veno-arterial extracorporeal membrane oxygenation). Aktualne wytyczne rekomendują rozważenie zastosowania czasowego mechanicznego wspomagania krążenia (IIa C) we wstrząsie kardiogennym jako leczenia pomostowego do momentu: poprawy stanu klinicznego (BTR – bridge to recovery), podjęcia decyzji (BTD – bridge to decision) lub wdrożenia innej terapii pomostowej (BTB – bridge to bridge)1,3 – tabela 1. Użycie urządzeń do krótkotrwałego mechanicznego wspomagania krążenia może także poprzedzać zastosowanie metod wspomagania długoterminowego czy zabieg transplantacji serca. Należy podkreślić jednak, że użycie tych urządzeń może wiązać się ze zwiększonym ryzykiem powikłań, wymaga również dużego doświadczenia w zakresie ich implantacji oraz prowadzenia pacjentów podczas ich stosowania1,3. Tym samym jest to postępowanie zasadniczo zarezerwowane dla ośrodków wyspecjalizowanych w leczeniu pacjentów ze wstrząsem kardiogennym1,2,6. Powyższe zalecenia są zgodne z rekomendacjami Asocjacji Intensywnej Terapii Kardiologicznej (AITK)/Asocjacji Interwencji Sercowo-Naczyniowych (AISN) Polskiego Towarzystwa Kardiologicznego (PTK)13, a także dokumentem eksperckim opracowanym przez European Association of Percutaneous Cardiovascular Interventions (EAPCI) we współpracy z Association for Acute Cardiovascular Care (ACVC)14.
Jedną z dostępnych opcji terapeutycznych jest użycie wewnątrznaczyniowej miniaturowej pompy osiowej Impella (Abiomed Inc., Danvers, Massachusetts, Stany Zjednoczone)1,2,14. Wspomaga ona lewą komorę serca poprzez wyrzucanie krwi z lewej komory do aorty wstępującej, mając możliwość generowania przepływu >5 l/min (w zależności od typu zastosowanego urządzenia oraz obciążenia następczego). W przeciwieństwie do Impella 5.0 wymagającej implantacji chirurgicznej, Impella 2.5 oraz Impella CP mogą zostać zastosowane w pełni przezskórnie – możliwe jest ich wprowadzenie w pracowni hemodynamiki przed wykonaniem lub w trakcie zabiegu PCI. W przeciwieństwie do IABP generowany przepływ krwi może być utrzymywany na stałym poziomie niezależnie od własnej czynności elektrycznej i mechanicznej serca. Nowa generacja pomp jest wyposażona w czujnik optyczny pozwalający lepiej kontrolować pozycję i działanie urządzenia. Pomimo wykazanej korzyści z zastosowania pompy Impella w trakcie planowych zabiegów PCI wysokiego ryzyka (koncepcja „protected PCI”) jej ewentualny wpływ na poprawę rokowania pacjentów ze wstrząsem kardiogennym nie jest tak jednoznaczny. Dotychczas zakończone badania, w tym głównie badania rejestrowe, wskazują na wyższe ryzyko powikłań krwotocznych, powikłań zakrzepowych, hemolizy, a nawet zwiększenie śmiertelności w grupie pacjentów leczonych przy użyciu tego urządzenia1,2,14. Ryzyko powikłań związanych z miejscem wkłucia może zostać zredukowane poprzez wprowadzenie do użytku pompy Impella ECP, będącej najmniejszą z dostępnych pomp. Wymaga ona dostępu przez koszulkę naczyniową 9F (ok. 3 mm średnicy), a następnie osiąga rozmiar operacyjny 18F. Przed usunięciem pompa jest ponownie składana do rozmiaru wyjściowego. Ewentualna korzyść wynikająca z zastosowania pompy typu Impella wydaje się głównie zarezerwowana dla przypadków jej wprowadzenia przed zabiegiem angiografii/PCI w porównaniu z przypadkami użycia po zabiegu rewaskularyzacji (krótszy czas od diagnozy do wspomagania). Więcej danych w tym zakresie przyniesie toczące się badanie randomizowane DanGer Shock. W przypadku pacjentów ze wstrząsem kardiogennym będącym następstwem ostrej niewydolności prawej komory serca istnieje możliwość zastosowania pompy Impella RP przeznaczonej do wspomagania tej komory1,2,14.
Inną pompą, która może być użyta do krótkotrwałego mechanicznego wspomagania krążenia, jest TandemHeart (LivaNova, Londyn, Wielka Brytania)1,2,14. Zasada jej działania opiera się na przepompowywaniu natlenowanej krwi z lewego przedsionka do tętnicy udowej. Pompa pozwala na uzyskanie przepływu do ok. 4 l/min. W trakcie jej implantacji konieczne jest wykonanie nakłucia transseptalnego, co może nastręczać pewnych trudności podczas zabiegów w AMI. Dotychczasowe badania wskazują na uzyskanie lepszych parametrów hemodynamicznych w porównaniu z IABP u pacjentów ze wstrząsem kardiogennym, jednak bez wpływu na śmiertelność1,2,14.
Miniaturyzacja i możliwość przezskórnego wprowadzenia kaniul bez konieczności interwencji chirurgicznej zwiększyła dostępność VA-ECMO, również w warunkach pracowni hemodynamiki1,2,14. Tym samym użycie tej metody znalazło zastosowanie w terapii pacjentów ze wstrząsem kardiogennym w przebiegu AMI. Niewątpliwą zaletą VA-ECMO jest niższy koszt zastosowania niż w przypadku pomp osiowych. Ponadto daje to możliwość wspomagania obu komór serca oraz uzyskania pełnego utlenowania krwi. Jednak dane kliniczne dotyczące tego zagadnienia są nadal ograniczone. Jedna z metaanaliz badań obserwacyjnych wskazywała na 3-krotną redukcję śmiertelności 30-dniowej u pacjentów ze wstrząsem kardiogennym niepoddawanych wcześniejszej resuscytacji w przypadku użycia VA-ECMO. Wyniki te nie znalazły jednak potwierdzenia w małym badaniu randomizowanym obejmującym 42 pacjentów ze wstrząsem kardiogennym1,2,14.
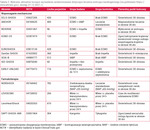
Tabela 2. Wybrane, aktualnie toczące się badania randomizowane dotyczące leczenia wstrząsu kardiogennego (na podstawie https://clinicaltrials.gov/; dostęp 27.12.2021 r.)
Aktualnie prowadzonych jest wiele badań randomizowanych o odpowiedniej mocy, które pozwolą na wiarygodną ocenę klinicznych punktów końcowych i potwierdzenie ewentualnej korzyści z użycia VA-ECMO w tej grupie chorych (ECMO-CS, ANCHOR, EUROSHOCK, ECLS-SHOCK) – tabela 2.
Ważnym zagadnieniem związanym z prowadzeniem pacjenta z zastosowaniem VA-ECMO pozostaje ryzyko przeciążenia objętościowego lewej komory związane ze wzrostem obciążenia następczego w wyniku obwodowego wprowadzenia kaniuli urządzenia1,2,14. W celu zapobiegania takiej sytuacji zaproponowano zastosowanie technik wentylowych, takich jak septostomia, użycie IABP lub pompy Impella2. Szczególnie to ostatnie rozwiązanie znajduje wielu zwolenników. Wykazano, że tzw. technika ECMELLA (VA-ECMO + Impella) może prowadzić do poprawy rokowania, jednak przy zwiększonym ryzyku krwawień i powikłań miejscowych związanych z dodatkowym zastosowaniem pompy Impella15. Warto podkreślić, że również inne metody wentylowe były przydatne w redukcji śmiertelności i zwiększeniu szansy na odstawienie leczenia wspomagającego2.
Podobnie jak w przypadku innych rodzajów mechanicznego wspomagania krążenia, użycie VA-ECMO wymaga dużego doświadczenia związanego nie tylko z prowadzeniem chorych, ale także kwalifikacją pacjentów o potencjalnie największym stosunku korzyści do ryzyka wynikającego z jego użycia. Zasady prowadzenia i monitorowania leczenia wspomagającego zostały omówione szczegółowo we wspomnianym wcześniej stanowisku AITK/AISN PTK13.
Hipotermia terapeutyczna i kontrola temperatury
Istotny odsetek pacjentów ze wstrząsem kardiogennym w przebiegu AMI stanowią chorzy po przedszpitalnym zatrzymaniu krążenia. Jego wystąpienie w znaczący sposób pogarsza rokowanie niezależnie od stopnia ciężkości samego wstrząsu określanego za pomocą skali SCAI1,2. O ile w przypadku pacjentów po zatrzymaniu krążenia bez wstrząsu kardiogennego hipotermia terapeutyczna czy też strategie kontroli temperatury ciała znajdują zastosowanie, o tyle w przypadku pacjentów ze wstrząsem dane są ograniczone. Na przykład badanie SHOCK-COOL nie potwierdziło istnienia istotnego, korzystnego wpływu łagodnej hipotermii terapeutycznej na parametry hemodynamiczne u pacjentów ze wstrząsem kardiogennym16. Toczące się badanie HYPO-ECMO ocenia ewentualny wpływ hipotermii terapeutycznej na wydolność narządową u pacjentów ze wstrząsem kardiogennym wspomaganych VA-ECMO.
Podsumowanie
Wstrząs kardiogenny w przebiegu AMI jest złożonym procesem, charakteryzującym się bardzo wysoką śmiertelnością. Ze względu na to, że u jego podstaw leży najczęściej znaczne uszkodzenie mięśnia lewej komory, z następową niewydolnością krążenia, niewydolnością wielonarządową i często zgonem, wysiłki powinny być skupione na ograniczaniu strefy zawału poprzez osiąganie jak najszybszej i pełnej reperfuzji. W przypadku wystąpienia wstrząsu kardiogennego najlepsze wyniki leczenia osiąga się w wyspecjalizowanych ośrodkach, działających w oparciu o wyznaczone do tego zespoły i wypracowane schematy standardowego postępowania. W przypadku braku możliwości bezpośredniego transportu chorego do tego typu ośrodka wstępne leczenie interwencyjne może być przeprowadzone w najbliższej pracowni hemodynamiki, a następnie pacjent powinien być przekazany do ośrodka o wyższym stopniu referencyjności dysponującego możliwością czasowego mechanicznego wspomagania krążenia.
Podobnie jak w przypadku innych grup chorych z ostrym zespołem wieńcowym, o ile jest to możliwe, należy preferować dostęp promieniowy. U pacjentów z chorobą wielonaczyniową rekomenduje się ograniczenie interwencji jedynie do tętnicy odpowiedzialnej za zawał. O ile pozwala na to stan kliniczny chorego, należy zaplanować dalsze etapy leczenia interwencyjnego w celu osiągnięcia pełnej reperfuzji. Rutynowe użycie wspomagania IABP nie jest aktualnie rekomendowane, natomiast w wybranych przypadkach wstrząsu nawrotowego należy rozważyć użycie metod czasowego wspomagania krążenia (Impella, VA-ECMO).
W przypadku pacjentów ze wstrząsem kardiogennym w przebiegu AMI powinno się stosować, przy braku przeciwwskazań, inhibitory P2Y12 o silnym efekcie działania (tykagrelor, prasugrel). Jednak biorąc pod uwagę zmniejszoną absorbcję leków doustnych, należy rozważyć dołączenie leków parenteralnych (kangrelor, inhibitory receptora płytkowego GP IIb/IIIa). Kluczowe jest utrzymanie odpowiedniej wolemii. W przypadku stosowania leków wazopresyjnych preferowana jest norepinefryna. Konieczne jest przeprowadzenie dalszych badań dotyczących przydatności czasowego mechanicznego wspomagania krążenia i wyodrębnienia grupy chorych mogących odnieść potencjalnie najwyższą korzyść z jego zastosowania. Przydatna może być identyfikacja czynników warunkujących odpowiedź na poszczególne rodzaje terapii, które umożliwiłyby jej indywidualizację w odniesieniu do poszczególnych pacjentów.
Istotnym uzupełnieniem terapii wstrząsu kardiogennego mogą być w przyszłości leki ograniczające proces zapalny i uszkodzenie narządowe w jego przebiegu. Niestety, do tej pory nie udało się zidentyfikować terapii skutecznej w tym zakresie.