Niewydolność serca
Niewydolność serca w wieku podeszłym
Danuta Karasek, Władysław Sinkiewicz
Wprowadzenie
Niewydolność serca (heart failure, HF) to stan, w którym wskutek zmian czynnościowych i strukturalnych w sercu pojemność minutowa ulega zmniejszeniu w stosunku do zapotrzebowania metabolicznego tkanek, co skutkuje wystąpieniem objawów klinicznych, lub w którym właściwa pojemność minutowa jest utrzymywana kosztem podwyższenia ciśnienia napełniania lewej komory [1]. Stanowi ona istotny, zwłaszcza ze względu na rokowanie, etap wielu chorób. Częstość występowania HF wzrasta z wiekiem. Z powodu HF jest aktualnie leczonych ok. 2% społeczeństwa, w tym jedynie ok. 17% pacjentów nie ukończyło 65 lat [2,3]. Ocenia się, że po 59 r.ż. częstość występowania tej choroby wzrasta dwukrotnie z każdą dekadą [4]. HF jest najczęstszą przyczyną przyjęć do szpitala i ponownych hospitalizacji osób w wieku podeszłym [5]. Roczna śmiertelność wśród osób starszych z HF sięga 30% [6], natomiast przeciętna 5-letnia śmiertelność wynosi ok. 50% – zarówno wśród osób z dysfunkcją skurczową, jak i u chorych z niewydolnością serca z zachowaną frakcją wyrzutową lewej komory (heart failure with preserved ejection fraction, HFPEF) [7]. Ponieważ liczba osób powyżej 65 r.ż. zwiększa się wykładniczo, co paradoksalnie jest związane z rozwojem opieki medycznej, postępem w leczeniu choroby niedokrwiennej serca, nadciśnienia tętniczego, wad serca i cukrzycy, problem HF staje się naglący i przybiera rozmiar epidemii.
Nie istnieje definicja człowieka starego. Starzenie się organizmu zaczyna się już około 30 r.ż., jednak zmiany fizjologiczne związane z wiekiem nie pojawiają się w określonym momencie ani nie są u wszystkich osób tak samo nasilone. Większość definicji starości opiera się na wieku kalendarzowym – według WHO jest to wiek >60 lat, według większości klasyfikacji amerykańskich granicę między wiekiem dojrzałym a podeszłym stanowi 65 r.ż. [8]. Również w pracach naukowych jako ludzi starszych określa się zwykle grupę ≥65 r.ż. Gerontolodzy wyróżniają także bardziej szczegółowy podział tego okresu życia, w zależności od biologicznych i klinicznych różnic okresów starości:
- wiek podeszły: od 60 do 74 r.ż.
- wiek starczy: od 75 do 89 r.ż.
- długowieczność: powyżej 90 r.ż.
Zmiany w układzie krążenia związane z wiekiem – od fizjologii do niewydolności serca
Przyczyną niewydolności serca u osób w wieku podeszłym są zarówno zmiany inwolucyjne układu krążenia, jak i choroby współistniejące.
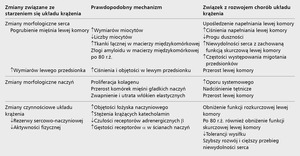
Tabela 1. Zależność między zmianami organicznymi i czynnościowymi związanymi ze starzeniem się układu krążenia a objawami klinicznymi [6]
Podczas starzenia się organizmu dochodzi do określonych zmian organicznych i czynnościowych w układzie krążenia (tab. 1). U osób starszych zwiększa się skurczowe ciśnienie tętnicze, ciśnienie tętna, masa lewej komory, zmniejszeniu ulega natomiast zdolność do zwiększenia rzutu serca w odpowiedzi na zwiększone zapotrzebowanie. W porównaniu z młodszymi osobami w krótszym czasie podczas wysiłku dochodzi do osiągnięcia maksymalnej wartości takich parametrów, jak: tętno, rzut serca, szczytowe zużycie tlenu, frakcja wyrzutowa, wczesnorozkurczowe ciśnienie napełniania [9,10].
Z wiekiem dochodzi do zwiększenia syntezy kolagenu w ścianie naczyń krwionośnych i spadku aktywności metaloproteinaz, stężenia angiotensyny II i TGF β, co prowadzi do zmniejszenia ilości włókien elastycznych oraz nasilenia włóknienia i wapnienia. Dochodzi do poszerzenia światła naczynia, pogrubienia jego błony wewnętrznej, a w konsekwencji do zmniejszenia elastyczności i podatności tętnic. Stwierdza się również spadek wydzielania tlenku azotu przez komórki śródbłonka [11]. W miarę starzenia się słabnie także odpowiedź naczyniowa na działanie czynników β-agonistycznych i α-antagonistycznych. Nie zmienia się natomiast reakcja naczyń na bodźce wazodylatacyjne (nitroprusydek sodu, nitrogliceryna), choć może ona ulec zaburzeniu przy współistnieniu cukrzycy i nadciśnienia tętniczego.
Oprócz zmian w naczyniach dochodzi także do zmian w przestrzeni pozakomórkowej mięśnia sercowego, takich jak: wzrost zawartości kolagenu i fibronektyny, zwiększenie średnicy miofibrylli, spadek ilości elastyny. Równolegle, w związku z apoptozą, zmniejsza się liczba komórek oraz dochodzi do upośledzenia ich funkcji [12]. Pojawiają się zaburzenia wychwytu wapnia, które prowadzą do wydłużenia czasu rozkurczu i skurczu. W mięśniu sercowym odkładają się także złogi amyloidu i lipofuscyny, co w konsekwencji zmniejsza jego elastyczność i podatność rozkurczową. Upośledzenie podatności mięśnia sercowego jest uznawane za główną przyczynę rozwoju HFPEF. W starzejącym się sercu powstają krzyżowe połączenia między włóknami białek strukturalnych, co z kolei daje sygnał makrofagom do gromadzenia się w miokardium i prowadzi do jego włóknienia, zwiększenia sztywności oraz dalszego pogarszania funkcji rozkurczowej mięśnia sercowego [13].
Zmiany degeneracyjne związane z włóknieniem oraz zmianą składu macierzy zewnątrzkomórkowej prowadzą także do zmniejszenia liczby komórek węzła zatokowo-przedsionkowego, co upośledza aktywność węzła oraz sprzyja występowaniu zaburzeń rytmu, zwykle migotania przedsionków, które znacznie upośledza napełnianie końcoworozkurczowe lewej komory [14]. Podobne mechanizmy w połączeniu ze zwapnieniami w okolicy węzła i odnóg pęczka Hisa są odpowiedzialne za powstawanie zaburzeń przewodzenia i zmiany degeneracyjne zastawek serca [12].
Do procesów inwolucyjnych w układzie krążenia należy także zaliczyć zmiany regulacji autonomicznego układu nerwowego. Z wiekiem zwiększa się napięcie układu współczulnego, co wyraża się podwyższonym stężeniem noradrenaliny w surowicy i obniżoną aktywnością układu RAA. W sercu osoby starszej dochodzi do desensytyzacji adrenergicznej – zmniejszenia wrażliwości komórek mięśnia serca na działanie agonistów receptorów β-adrenergicznych [15], co wynika ze zmniejszenia liczby receptorów β-adrenergicznych w układzie β-adrenergicznym, a w układzie α-adrenergicznym zmniejszenia liczby i reaktywności receptorów płytkowych. Zmniejsza się również liczba receptorów dopaminergicznych o działaniu poprawiającym kurczliwość mięśnia sercowego. Ostatecznym rezultatem opisywanych zmian jest osłabienie odruchu z baroreceptorów, zmniejszenie odpowiedzi na czynniki stresowe oraz wzrost wrażliwości na stymulację parasympatyczną ośrodkowego układu nerwowego [12].
Niekorzystne zmiany związane z wiekiem przyspieszające rozwój miażdżycy zachodzą również w środowisku wewnątrznaczyniowym. Dochodzi do wzrostu stężenia fibrynogenu, czynników V, VIII, IX oraz innych białek krzepnięcia bez kompensacyjnego wzrostu stężenia czynników przeciwkrzepliwych. Zwiększa się zawartość fosfolipidów w płytkach, co nasila aktywność agregacyjną. Ze zwiększoną aktywnością inhibitora aktywatorów plazminogenu typu 1 (PAI 1) wiąże się spadek aktywności fibrynolizy wewnątrznaczyniowej. Dochodzi do wzrostu stężenia cytokin zapalnych o właściwościach prozakrzepowych – głównie interleukiny 6 [11,16].
Starzenie się organizmu predysponuje do rozwoju niewydolności serca, ponieważ, jak twierdzi Ferrara, zmiany jakościowe zachodzące w sercu starczym są analogiczne do zachodzących w sercu niewydolnym. Stan określany jako presbycardia lub cor senile wyjaśnia istotę wczesnego etapu niewydolności rozkurczowej, będącej granicą między fizjologicznym starzeniem się serca a stanem patologicznym (tab. 2, ryc. 1) [15].
Zależnie od wieku pacjenta zmienia się stosunek niewydolności skurczowej do niewydolności serca z zachowaną funkcją skurczową lewej komory. W wieku <60 r.ż. HFPEF występuje u ok. o 6% chorych, >70 r.ż – już u 40%, a u osób w wieku 80 lat stanowi 50% przypadków niewydolności serca [17].
Obraz kliniczny niewydolności serca u ludzi starszych
Obraz kliniczny HF u osób w wieku podeszłym może być inny niż u młodych w związku ze współistnieniem objawów innych chorób (ryc. 2). Rozpoznanie może również utrudniać stopniowe pojawianie się objawów, nie zawsze charakterystycznych. Wywiad, który jest podstawą rozpoznania, bardzo często jest trudny do przeprowadzenia. Męczliwość i duszność wysiłkowa mogą być przypisywane starzeniu się, a jednocześnie z powodu ograniczenia aktywności fizycznej późno się ujawniają (tab. 3). Klasyfikacja NYHA jest w tej grupie pacjentów zdecydowanie mniej przydatna [18].



