Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 23:59! Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
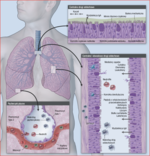
Interakcje wirusow i bakterii
Zaostrzenia wywołane jednocześnie przez wirusy i bakterie przebiegają ciężej i są związane z wyższymi stężeniami markerów zapalnych niż zakażenia wywołane przez same wirusy lub bakterie.16,21 Wirusy powodują ekspresję molekuł adhezyjnych na powierzchni komórek nabłonka dróg oddechowych, co ułatwia bakteriom adhezję i inwazję.27 Podobnie, wcześniejsze zakażenie bateryjne może zwiększać podatność na zakażenie wirusowe przez nasilenie ekspresji molekuł adhezyjnych na powierzchni komórek gospodarza, z którymi wiążą się wirusy.28 Te koncepcje wyjaśniają, jak wcześniejsza infekcja może zwiększać prawdopodobieństwo wystąpienia kolejnej i nasilać jej objawy.
Przewlekłe zakażenie w POChP
Fizjologicznie drogi oddechowe są jałowe, natomiast u chorych na POChP w drogach oddechowych często występują patogenne drobnoustroje (tab. 1). Ich obecność można stwierdzić w plwocinie, materiale pobranym szczoteczką w trakcie bronchoskopii, popłuczynach oskrzelowo-pęcherzykowych i bioptatach z oskrzeli. Wykrywa się je za pomocą hodowli i innych technik niehodowlanych u 25-50% chorych na POChP w okresie stabilnym choroby, a częstość ta wzrasta wraz z nasileniem obturacji oskrzeli.3,4,29,30 Ponieważ obecności patogenów nie towarzyszy ostre zakażenie, zjawisko to określa się jako kolonizację. Zgodnie z definicją kolonizacji obecność patogenów nie powinna jednak powodować reakcji gospodarza i szkodliwych dla niego skutków. W kilku ostatnich badaniach wykazano natomiast, że w stabilnej postaci POChP obecność bakterii wiąże się z reakcją zapalną i immunologiczną gospodarza.
Kolonizacja bakteriami i zapalenie
U pacjentów chorujących na POChP, u których stwierdzono w plwocinie obecność kolonizujących bakterii, zaobserwowano również w tym materiale wyższe niż u pacjentów, u których nie występuje ten patogen, stężenie cytokin i chemokin (TNF-α, IL-8, leukotrienu B4) oraz produktów degradacji neutrofilów (mieloperoksydazy, elastazy). 31,32 Plwocina odzwierciedla jednak środowisko centralnych dróg oddechowych. W bronchoskopii pobiera się próbki z obwodowych części drzewa oskrzelowego, gdzie w POChP rozpoczyna się proces chorobowy. Dwa badania oceniające popłuczyny oskrzelowo-pęcherzykowe wykazały zwiększenie liczby neutrofilów, stężenia TNF-α, IL-8 i metaloproteinazy 9, towarzyszące kolonizacji bateriami w POChP.30,33
Kolonizacja bakteriami i związane z nią zapalenie pojawiają się na wczesnym etapie choroby u palaczy z przewlekłym nieobturacyjnym zapaleniem oskrzeli i utrzymują się u chorych na POChP mimo zaprzestania palenia.30,33 Zapalenie dróg oddechowych związane z kolonizacją bakteriami ma charakter neutrofilowy, a jego głównym mediatorem jest IL-8. Mediator ten oraz neutrofile odgrywają kluczową rolę w rozwoju POChP. Wytwarzanie IL-8 i neutrofilowe zapalenie dróg oddechowych są związane zarówno z rozedmą u bezobjawowych palaczy tytoniu, jak i z nadmierną produkcją plwociny, nasilającą się obturacją dróg oddechowych i dysfunkcją dystalnych odcinków dróg oddechowych u chorych na POChP.34-36 Zapalenie spowodowane kolonizacją dróg oddechowych ma zatem udział w rozwoju POChP na wszystkich jego etapach.
Inne dowody na przewlekłe zakażenie
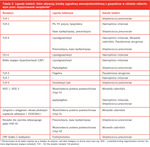
Tabela 2. Ligandy bakterii, które aktywują ścieżkę sygnałową wewnątrzkomórkową u gospodarza w układzie oddechowym przez rozpoznawanie receptorów*
Teorię, zgodnie z którą u chorych na POChP kolonizacja bakteryjna jest czynnikiem inicjującym zakażenie, potwierdza rozwój swoistej reakcji immunologicznej pod wpływem kolonizacji bakteryjnej. U chorych na POChP, u których doszło do kolonizacji bakteriami M. catarrhalis, P. aeruginosa, H. influenzae i S. pneumoniae, obserwuje się wzrost stężenia przeciwciał klasy IgG w surowicy.9,10
Za przewlekłym zakażeniem w POChP przemawiają również dowody patomorfologiczne i radiologiczne. W okresie narastania obturacji u chorych na POChP w drobnych oskrzelach obecne są grudki chłonne bogate w limfocyty B, co można uznać za reakcję tkankową na przewlekłe miejscowe zakażenie.37 Tomografia komputerowa wysokiej rozdzielczości wykazuje natomiast, że u osób z zaawansowaną postacią POChP często występują rozstrzenie oskrzeli.38 Przewlekłe zakażenia są ważnym czynnikiem w mukowiscydozie i w rozstrzeniach oskrzeli niezwiązanych z mukowiscydozą. Obserwacje te potwierdzają tezę, że przewlekłe, niezbyt nasilone zakażenia w POChP mogą pogarszać przebieg choroby prawdopodobnie przez destrukcję dróg oddechowych i tworzenie rozstrzeni oskrzeli.
Inne przewlekłe zakażenia
Wraz ze wzrostem zaawansowania obturacji w POChP częściej dochodzi do kolonizacji przez Chlamydophila pneumoniae i Pneumocystis jiroveci.39,40 Znaczenie tego zjawiska jest obecnie badane. Pacjenci zakażeni HIV są bardziej podatni na rozwój rozedmy niż osoby niezakażone, a zakażenia pneumocystozowe w intrygujący sposób wiążą te dwie choroby.41 Utajone zakażenia adenowirusami, częstsze u chorych na POChP niż u osób, u których nie występują choroby płuc, mogłyby również uczestniczyć w patogenezie POChP przez nasilenie reakcji zapalnej na dym tytoniowy.42
Mechanizmy przewlekłego zakażenia w POChP
Określając częstość występowania przewlekłych zakażeń w POChP na podstawie wyników rutynowych hodowli bakterii uzyskanych z próbek plwociny lub bronchoskopowych popłuczyn oskrzelowo-pęcherzykowych, należy liczyć się z możliwością niedoszacowania.10,29 Obecność H. influenzae w świetle dróg oddechowych (plwocinie), nabłonku oskrzeli i wewnątrzkomórkowo w podnabłonkowych makrofagach zidentyfikowano za pomocą innych niż hodowla metod.4,29 Nie wiadomo, czy u chorych na POChP H. influenzae i P. aeruginosa tworzą biofim, jak w przypadku chorych na mukowiscydozę.43
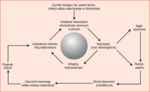
Niewoiste mechanizmy obronne w płucach
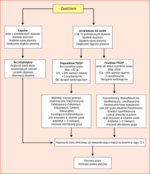
Rycina 4. Rycina 4. Algorytm antybiotykoterapii u pacjentów z nagłym zaostrzaniem POChP
Za utrzymywanie jałowego środowiska w zdrowych płucach odpowiadają nieswoiste mechanizmy obronne, które cechują złożoność i wysoka aktywność (ryc. 2). Istnieje kilka rodzajów dysfunkcji nieswoistych mechanizmów obronnych w przebiegu POChP. Najważniejszym z nich jest prawdopodobnie upośledzenie transportu śluzowo-rzęskowego, który to defekt występuje powszechnie, choć ze zmiennym nasileniem u palaczy tytoniu o umiarkowanym i ciężkim stopniu uzależnienia. Płynna wyściółka dróg oddechowych jest bogata w endogenne białka o działaniu przeciwbakteryjnym, m.in. białko kationowe i kolektyny. Niektóre z tych białek pełnią ważną funkcję immunoregulacyjną. U palaczy tytoniu stężenia białek surfaktantu A i D zmniejszają się, a zjawisko to nasila się w przypadku współistniejącej rozedmy.44 Zaobserwowano również związek częstych zaostrzeń z niedoborami lizozymu w ślinie i wydzielanego przez leukocyty inhibitora proteaz.45,46