Związek mikroorganizmów z otyłością.
Aktywność metaboliczna mikroflory jelitowej ułatwia pozyskiwanie energii z trawionych składników pożywienia, pomaga magazynować tę energię w tkance tłuszczowej człowieka w celu późniejszego jej wykorzystania oraz zapewnia energię i pożywienie niezbędne dla wzrostu czy rozmnażania samych bakterii. Indywidualne różnice we wspomnianym wykorzystaniu energii mogą stanowić logiczne z punktu widzenia fizjologii wyjaśnienie obserwowanej dość często sytuacji, kiedy to otyli pacjenci nie wydają się spożywać nadmiernych ilości pokarmu. Sugeruje się, że mikroflora jelitowa każdego człowieka ma pewną „wydolność” metaboliczną, a do otyłości predysponuje określona kompozycja gatunków bakterii jelitowych.34
Uzyskiwanie energii z pożywienia
Backhed i wsp.40 odkryli w serii doświadczeń, że w organizmach młodych myszy hodowanych w zwykłych warunkach zawartość tłuszczu jest o 40% większa niż u myszy hodowanych sterylnie (germ-free), mimo że zjadały mniej pożywienia niż myszy germ-free. Następnie drobnoustroje zasiedlające dystalną część jelita myszy przenoszono do jelit myszy germ-free (proces ten określa się jako konwencjonalizację), uzyskując w ciągu 2 tygodni 60% wzrost tłuszczowej masy ciała przy niezmienionej ilości przyjmowanego pokarmu i stałej ilości traconej energii. Wyniki tych doświadczeń potwierdzają hipotezę mówiącą, że skład mikroflory jelitowej wpływa na ilość energii uzyskiwanej z trawionego pożywienia. Przyrostowi masy ciała towarzyszyły: insulinooporność, hypertrofia adipocytów oraz wzrost stężenia leptyny i glukozy we krwi.
Wyjaśniając mechanizmy leżące u podstaw tych zjawisk, badacze wykazali, że bakterie nasilają wchłanianie monosacharydów w jelicie oraz indukują lipogenezę w wątrobie gospodarza; czynią to za pośrednictwem dwóch białek sygnałowych: białka ChREBP (carbohydrate response element-binding protein) i białka SREBP-1 (liver sterol response element-binding protein type-1). Na koniec, używając myszy pozbawionych genu dla czynnika tkankowego indukowanego głodzeniem (Fiaf – fasting-induced adipocyte factor) wykazali, że mikroorganizmy jelitowe hamują jelitowy Fiaf, znany również pod nazwą białka podobnego do angiopoetyny 4. Fiaf hamuje aktywność lipazy lipoproteinowej, przez co ułatwia uwalnianie kwasów tłuszczowych ze związanych z lipoproteinami triacylogliceroli, które następnie wychwytywane są przez mięśnie i tkankę tłuszczową. W omawianym badaniu blokowanie Fiaf skutkowało wzrostem aktywności lipazy lipoproteinowej w komórkach tłuszczowych i nasileniem procesu magazynowania kalorii w postaci tłuszczu, co skłoniło Backheda i wsp. do sformułowania tezy, że mikroorganizmy jelitowe wpływają na gospodarkę energetyczną za pośrednictwem serii wzajemnie powiązanych mechanizmów. Do mechanizmów tych należą: rozkład zawartych w pożywieniu niestrawialnych polisacharydów do form prostszych, wchłanialnych związków, wchłanianie w jelitach monosacharydów i krótkołańcuchowych kwasów tłuszczowych oraz ich następowa konwersja do tłuszczów w wątrobie, a także wpływ na ekspresję genów gospodarza i w efekcie nasilenie magazynowania tłuszczów w komórkach tłuszczowych.
W kolejnym badaniu, mającym na celu wyjaśnienie mechanizmów odpowiedzialnych za brak otyłości u myszy germ-free, Backhed i wsp.41 obserwowali myszy germ-free żywione klasyczną dietą zachodnią, zawierającą duże ilości tłuszczu i cukrów. Zauważyli, że myszy germ-free chronione są przed otyłością pokarmową przez dwa wzajemnie się dopełniające, lecz niezależne mechanizmy nasilające metabolizm kwasów tłuszczowych: 1) zwiększone stężenie Fiaf będące sygnałem do wytwarzania koaktywatorów dla PPARγ (peroxisome proliferator-activated receptor γ coactivator), co jak wiadomo nasila ekspresję genów kodujących białka regulujące intensywność utleniania kwasów tłuszczowych w mitochondriach; 2) zwiększoną aktywność kinazy proteinowej zależnej od monofosforanu adenozyny (AMPK – adenosine monophosphate-activated protein kinase), enzymu regulującego stan energetyczny komórki. Odkrycia te sugerują, że mikroorganizmy jelitowe mogą wpływać na obydwie składowe bilansu energetycznego, regulując uzyskiwanie energii z pożywienia (Fiaf) i wpływając na ekspresję genów odpowiedzialnych za magazynowanie i wydatkowanie energii.41
Turnbaugh i wsp.42 szukali wyjaśnienia, w jaki sposób geny mikroorganizmów jelitowych przyczyniają się do otyłości. Na początku scharakteryzowali oni mikrobiomy mikroorganizmów bytujących w dystalnej części jelita u zmodyfikowanych genetycznie, pozbawionych leptyny otyłych myszy (ob./ob.) i myszy szczupłych (ob./+ i +/+). Użyto myszy, aby uniknąć kłopotliwych różnic w diecie, środowisku i genotypie, które zwykle czynią podobne badania z udziałem ludzi trudnymi w interpretacji. W serii doświadczeń z użyciem technik metagenomiki porównawczej wykazano, że mikroorganizmy w jelitach myszy ob./ob. posiadają geny kodujące enzymy, dzięki którym możliwy jest rozkład niestrawialnych w inny sposób polisacharydów, będących częścią pożywienia. W stolcu otyłych myszy znaleźli oni ponadto więcej końcowych produktów fermentacji (kwas octowy i masłowy) oraz mniejszą liczbę kalorii, co skłoniło badaczy do przypuszczenia, że mikroorganizmy bytujące w jelitach tych myszy ułatwiają uzyskiwanie dodatkowych kalorii z trawionego pożywienia.
Aby wykazać, że skład mikroflory jelitowej ma wpływ na masę ciała, naukowcy dokonali transferu mikroorganizmów z jelit myszy ob./ob. i myszy szczupłych do jelit szczupłych myszy germ-free. Po dwóch tygodniach myszy, które otrzymały bakterie od myszy ob./ob., pozyskiwały więcej kalorii z pożywienia i wykazywały znacznie większy przyrost tkanki tłuszczowej niż myszy, które otrzymały bakterie od myszy szczupłych (średni przyrost tkanki tłuszczowej SD, 47%8,3% vs 27%3,6% co odpowiada różnicy 4 kcal lub 2% wszystkich spożytych kalorii przy założeniu, że 9,3 kcal przypada na 1 g tkanki tłuszczowej).42 Uzyskane wyniki sugerują, że różnice w pozyskiwaniu kalorii z trawionego pożywienia mogą być uzależnione od składu mikroflory jelitowej, co potwierdza potencjalny udział flory jelitowej w patogenezie otyłości. Wyniki te skłaniają również do stawiania pytań. Czy tak niewielkie różnice w uzyskiwaniu energii z pożywienia mogą przekładać się na klinicznie znaczące różnice masy ciała? Jak zmiany zachodzące w organizmie gospodarza (jak np. mutacja genu leptyny u myszy ob./ob.) determinują różnice w składzie mikroflory jelitowej? Czy różnice te utrzymują się przez dłuższy czas? Aby wyjaśnić te wątpliwości konieczne jest przeprowadzenie dalszych badań.
Przewlekły uogólniony stan zapalny
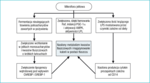
Rycina 3. Mechanizmy, za pośrednictwem których mikroorganizmy jelitowe mogą przyczyniać się do rozwoju otyłości
Na podstawie ostatnich doniesień, według których otyłość i insulinooporność związane są z przewlekłym uogólnionym stanem zapalnym o nieznacznym nasileniu,43 Cani i wsp.44 zaproponowali kolejny mechanizm łączący mikroflorę jelitową z rozwojem otyłości. Założyli oni, że bakteryjny lipopolisacharyd (LPS), którego źródłem są Gram-ujemne bakterie bytujące w jelitach, jest swego rodzaju czynnikiem wyzwalającym, łączącym stan zapalny z zespołem metabolicznym indukowanym dietą bogatą w tłuszcze. W serii doświadczeń na myszach otrzymujących pożywienie o dużej zawartości tłuszczu, wykazali oni, że: 1) dieta bogata w tłuszcze zwiększa endotoksemię i wpływa na to, które gatunki bakterii dominują w mikroflorze jelitowej: redukuje ilość zarówno bakterii Gram-ujemnych (grupa Bacteroides), jak i Gram-dodatnich (grupa Eubacterium rectale – Clostridium coccoides i bifidobacteria), zmieniając stosunek bakterii Gram-ujemnych do Gram-dodatnich na korzyść tych pierwszych; 2) przewlekła endotoksemia indukuje rozwój otyłości, powstawanie insulinooporności oraz cukrzycy. Używając myszy ze zmutowanym genem CD14 żywionych dietą bogatą w tłuszcze, wykazali oni, że endotoksemia nasila ekspresję cytokin prozapalnych (TNF-α, IL-1, IL-6, inhibitora 1 aktywatora plazminogenu) w mechanizmie zależnym od CD14. Będąc molekułą o kluczowym znaczeniu, CD14 wiąże bakteryjny lipopolisacharyd (LPS) na powierzchni komórek układu odpornościowego gospodarza, powodując wydzielanie cytokin prozapalnych.45 Sugeruje się, że kompleks LPS/CD14 reguluje próg wrażliwości na insulinę i w związku z tym wpływa na występowanie otyłości i cukrzycy.44 Badania z udziałem ludzi potwierdziły zasadność powyższych wniosków. Wykazano, że leczenie polimyksyną B, antybiotykiem o dużej skuteczności w stosunku do bakterii Gram-ujemnych, zmniejszało ekspresję LPS i stopień stłuszczenia wątroby.46 Najnowsze badania wykazały większe stężenie LPS u chorych na cukrzycę typu 2 niż u starannie dobranych pacjentów z grupy kontrolnej, u których wykluczono cukrzycę.47 Na rycinie 3 przedstawiono prawdopodobne mechanizmy, za pośrednictwem których mikroflora bakteryjna wpływa na rozwój otyłości.
Skład mikroflory jelitowej u otyłych i szczupłych myszy
Aby porównać bardzo dużą liczbę gatunków mikroorganizmów jelitowych obecnych w jelitach otyłych i chudych myszy, Ley i wsp.18 analizowali sekwencję genów 16S rRNA bakterii pobranych z kątnic myszy genetycznie otyłych (ob./ob.), ich rodzeństwa (ob./+ i +/+) oraz ich matek ob./+, przy czym wszystkie myszy były karmione tym samym, bogatym w polisacharydy pokarmem. Wykazali oni, że u myszy ob./ob. liczba bakterii Bacteroides była o 50% mniejsza a liczba Firmicutes odpowiednio większa niż u myszy chudych, czego nie można przypisać różnicom w spożywanym pokarmie. Zmiany te zaobserwowano w całej grupie myszy i nie były one wynikiem nieznacznego zwiększenia bądź zmniejszenia liczby Bacteroides czy Firmicutes u poszczególnych osobników. Wyjaśnienie mechanizmów odpowiedzialnych za te różnice wymaga dalszych badań. Ley i wsp. wykazali również istnienie silnej zależności pomiędzy stopniem pokrewieństwa a składem mikroflory jelitowej, choć różnice w składzie flory obserwowane u otyłych myszy nie były zależne od stopnia pokrewieństwa czy płci. Wyniki omawianych badań sugerują istnienie różnic w składzie mikroflory jelitowej myszy chudych i otyłych, co wskazywałoby na możliwość manipulowania składem tejże mikroflory także u ludzi, w celu przywrócenia równowagi energetycznej u osób otyłych.
Skład mikroflory jelitowej u otyłych i szczupłych ludzi
Aby wykazać, że doświadczenia na zwierzętach przekładają się na człowieka, Ley i wsp.24 monitorowali skład bakterii obecnych w stolcu 12 otyłych osób podczas trwającego rok programu zmniejszania masy ciała, przydzielając ich w sposób losowy do grupy otrzymującej dietę o obniżonej zawartości tłuszczu lub obniżonej zawartości węglowodanów. Podobnie jak podczas doświadczeń na myszach, w składzie mikroflory jelitowej badanych ludzi dominowali przedstawiciele gatunków Bacteroides i Firmicutes, przy czym skład ten wykazywał znaczną stałość osobniczą. Przed wdrożeniem diety w mikroflorze jelitowej osób otyłych mniej było bakterii Bacteroides a więcej Firmicutes niż w grupie kontrolnej u osób szczupłych. Po zmniejszeniu masy ciała stosunek Bacteroides do Firmicutes zwiększył się w stopniu zależnym od procentowej redukcji masy ciała, niezależnym natomiast od podaży kalorii. Bakterie Bacteroides stanowiły ok. 3% wszystkich bakterii jelitowych u osób badanych przed redukcją masy ciała i ok. 15% wszystkich bakterii jelitowych po zakończonym z powodzeniem programie redukcji masy ciała. Nieznana jest jak dotąd przyczyna obecności większej liczby bakterii Firmicutes w jelitach osób otyłych. Jest to być może spowodowane właściwościami jelita gospodarza, dzięki którym wyselekcjonowana została ta akurat gromada, obejmująca ponad 250 rodzajów i zróżnicowane możliwości metaboliczne. Dla przykładu, wiele szczepów Bacillus należy do fakultatywnych tlenowców, podczas gdy bakterie z rodzaju Clostridium to obligatoryjne beztlenowce. Duże zróżnicowanie w rodzinie Firmicutes może powodować skuteczniejsze pozyskiwanie energii z różnych substancji organicznych. Wyjaśnienie związku przyczynowo-skutkowego pomiędzy otyłością a florą bakteryjną jelit wymaga dalszych badań.
Homeostaza energetyczna
Choć bakterie Bacteroides i Firmicutes są dominującymi mikroorganizmami mikroflory jelitowej, to obecne są tam również wytwarzające metan archeowce. Metanogeneza archeowcowa, zapobiegając gromadzeniu się wodoru i innych produktów przemiany materii, zwiększa skuteczność rozkładu polisacharydów. Co więcej, produkcja metanu pochłania duże ilości energii i wolnych elektronów, więc energia ta jest niedostępna dla organizmu gospodarza. Z tego powodu hodowcy bydła próbują zmniejszyć powstawanie metanu w żwaczach krów. W odróżnieniu od żwacza, w którym bytują drobnoustroje metanogenne, utylizujące kwas octowy, takie jak Methanosarcina species,48 w ludzkim przewodzie pokarmowym dominują archeowce Methanobrevibacter species, utleniające wodór i kwas mrówkowy,13 co wskazuje, że powstające w wyniku działania bakterii fermentujących w jelicie grubym kwasy masłowy i octowy nie są wykorzystywane przez drobnoustroje wytwarzające metan. Methanobrevibacter species, usuwając wodór i kwas mrówkowy, mogą powodować zwiększone wytwarzanie przez bakterie jelitowe kwasu octowego i masłowego, będących ważnymi źródłami węgla dla komórek nabłonka jelitowego. W rezultacie tego typu współdziałanie pomiędzy bakteriami a archeowcami w jelicie człowieka może prowadzić do zwiększenia ilości energii uzyskiwanej z zawartych w pożywieniu niestrawialnych polisacharydów.
W celu wyjaśnienia roli poszczególnych gatunków bakterii Samuel i Gordon49 skolonizowali jelita myszy germ-free drobnoustrojami Methanobrevibacter smithii, Bacteroides thetaiotaomicron bądź obydwoma gatunkami tych drobnoustrojów. Bacteroides thetaiotaomicron jest powszechnie występującą w jelicie grubym bakterią skutecznie metabolizującą polisacharydy i przez to umożliwiającą trawienie oraz uzyskiwanie dodatkowej energii z niestrawialnych w inny sposób węglowodanów.50 Najważniejszym spośród archeowców występujących w jelicie ludzkim jest Methanobrevibacter smithii, stanowiący 10% wszystkich mikroorganizmów beztlenowych w jelitach zdrowych osób dorosłych.31 Wpływ archeowców na zdrowie człowieka nie został jednak wyjaśniony. Samuel i Gordon49 wykazali, że jednoczesna kolonizacja M. smithii i B. thetaiotaomicron zwiększa skuteczność uzyskiwania energii z polisacharydów zawartych w pożywieniu i ilość tkanki tłuszczowej bardziej niż kolonizacja każdym z tych drobnoustrojów z osobna. Co więcej Samuel i wsp.51 zauważyli, że M. smithii wpływał na metabolizm B. thetaiotaomicron, powodując, że ten żywił się głównie polisacharydami zawierającymi fruktozę, które metabolizował do mniejszych cząstek, w tym mrówczanu, będącego ważnym źródłem energii dla M. smithii. Odkrycia te potwierdzają nie tylko korzystny wpływ archeowców na trawienie pokarmów, lecz także rolę wzajemnych oddziaływań mikroorganizmów jelitowych w utrzymaniu homeostazy energetycznej. Prezentują one także interesującą możliwość wykorzystania M. smithii jako czynnika terapeutycznego w leczeniu otyłości, powodującego zmniejszenie liczby kalorii uzyskiwanych z trawionego pożywienia.
Modyfikacja ekosystemu jelitowego jako strategia terapeutyczna
Najlepszą niechirurgiczną metodą leczenia otyłości może być wprowadzanie niewielkich, lecz trwałych zmian w diecie przy jednoczesnym zwiększaniu aktywności fizycznej w celu przełamania dotychczasowego schematu regulacji równowagi energetycznej w organizmie i zapobiegania powstawaniu dodatniego bilansu energetycznego.3 Dokładna rola mikroorganizmów jelitowych w regulacji bilansu energetycznego pozostaje nieznana, ale badania systemów regulujących ten bilans sugerują, że skumulowany efekt działania bakterii jelitowych może na dłuższą metę należeć do ważniejszych czynników wpływających na równowagę energetyczną. Oczywiście nic nie zastąpi odpowiedniej diety i wysiłku fizycznego, jednak modyfikacja mikroflory jelitowej może okazać się skuteczną metodą leczenia otyłości, co istotne, pozbawioną działań niepożądanych. Stosowanie leków przeciwbakteryjnych, prebiotyków i probiotyków może skutkować nieswoistymi zmianami mikroflory jelitowej.