Program edukacyjny: hipertensjologia
Drugi typ enzymu konwertującego angiotensynę. Możliwa rola w nadciśnieniu tętniczym i chorobach nerek
Jan Wysocki, MD, PhD
Francisco R. González-Pacheco, PhD
Daniel Battle, MD
W SKRÓCIE
Odkrycie 2 typu enzymu konwertującego angiotensynę (ACE2) wprowadza nowy stopień złożoności w postrzeganiu układu renina-angiotensyna. Duża sprawność katalityczna ACE2, wytwarzającego angiotensynę (Ang) 1-7 z Ang II, wskazuje na ważną funkcję ACE2 jako mechanizmu zapobiegającego gromadzeniu się Ang II, a jednocześnie zwiększającego wytwarzanie Ang 1-7. ACE i ACE2 mogą wywierać przeciwstawne działania, ściśle regulując szybkość wytwarzania i degradacji peptydów angiotensyny. Przeciwdziałając aktywności ACE w zakresie wytwarzania Ang II, ACE2 może odgrywać rolę w utrzymywaniu odpowiedniej równowagi układu renina-angiotensyna. W przeglądzie skoncentrowano się na działaniu ACE2 oraz jego możliwej roli w chorobach nerek i nadciśnieniu tętniczym. Na podstawie wyników badań, w których stosowano modele genetycznej ablacji ACE2 oraz stosowano inhibitory ACE2, można sądzić, że zmniejszona aktywność ACE2, sama lub w połączeniu ze zwiększoną aktywnością ACE, może odgrywać rolę w obu tych chorobach.
Wprowadzenie
Pierwszy ludzki homolog enzymu konwertującego angiotensynę (ACE), nazwany enzymem konwertującym angiotensynę typu 2 (ACE2), został zidentyfikowany w 2000 r. przez dwie niezależne grupy badawcze stosujące metody genomiczne.1,2 Gen kodujący ACE2, oznaczany jako Ace2, znajduje się na chromosomie X. Podobnie jak ACE, ACE2 jest integralnym białkiem błonowym typu 1, zawiera jednak tylko jedną aktywną domenę i składa się z 805 aminokwasów.1,2 ACE2 działa jako karboksypeptydaza usuwająca pojedyncze aminokwasy z C-końca cząsteczek jej substratów, natomiast ACE działa głównie jako peptydylodipeptydaza, która usuwa C-końcowe dipeptydy. Metaloproteazowe domeny katalityczne ACE2 i ACE są identyczne w 41%, a wyniki porównania struktury genomicznej wskazują, że te dwa geny powstały w wyniku duplikacji wspólnego przodka.1,2 Dzięki poznaniu trójwymiarowej struktury zewnątrzkomórkowej domeny ACE23 stwierdzono, że mechanizm katalityczny ACE2 ściśle przypomina mechanizm katalityczny ACE. Kieszenie wiążące substrat różnią się jednak istotnie,3 co tłumaczy różnice swoistości substratów między dwoma enzymami, a także brak wiązania inhibitorów ACE i hamowania ACE2 przez te leki.4
ACE2 jest jedynym znanym aktywnym enzymatycznie homologiem ACE w ludzkim genomie. Koniec karboksylowy cząsteczki ACE2 jest homologiczny z kolektryną.5 W przeciwieństwie do ACE i ACE2 kolektryna nie ma właściwości katalitycznych karboksypeptydazy i początkowo zlokalizowano ją w cewkach zbiorczych.5 Ostatnio jednak zidentyfikowano ją również w cewkach bliższych, gdzie uczestniczy w regulacji wychwytu aminokwasów.6,7 Wskazywano też na możliwą rolę kolektryny w tworzeniu się i rozwoju pęcherza moczowego poprzez interakcję z integralnymi białkami błonowymi swoistymi dla rzęsek.8 W genomach kilku gatunków ssaków zidentyfikowano jeszcze inny gen kodujący nowe, składające się z jednej domeny białko podobne do ACE, które nazwano ACE3. Wydaje się, że u kilku gatunków ACE3 nie wykazuje aktywności katalitycznej jako metaloproteaza cynkowa.9 Co więcej, u ludzi w ogóle nie uzyskano dowodów ekspresji genu kodującego ACE3, a obecność delecji i insercji w jego sekwencji pozwala sądzić, że u ludzi sekwencja kodująca ACE3 jest pseudogenem.9
Obecność ACE2 początkowo wykryto w sercu, nerkach i jądrach, a mniejsze ilości tego enzymu również w okrężnicy, jelicie cienkim i jajnikach.10 ACE2 zidentyfikowano też w płucach, gdzie odgrywa on ważną rolę w metabolizmie angiotensyny (Ang) II.11,12 ACE2 chroni myszy przed ciężkim uszkodzeniem płuc wywoływanym przez aspirację kwaśnej treści, sepsę lub zakażenie wirusem ciężkiej ostrej niewydolności oddechowej (SARS).11,12 Jako pierwsi wyraziliśmy pogląd, że ACE2 może działać ochronnie na nerki, zwłaszcza w połączeniu z małą aktywnością ACE.13 Najnowsze prace przeprowadzone w naszym laboratorium potwierdzają tę hipotezę.14-16 W przeglądzie omawiamy ostatnie publikacje dotyczące ACE2 jako szlaku metabolizmu Ang II oraz możliwej roli tego enzymu w nadciśnieniu tętniczym i nefropatii cukrzycowej.
Substraty ACE2
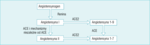
Rycina 1. Strzałki pionowe po lewej stronie przedstawiają klasyczny szlak powstawania angiotensyny II z udziałem enzymu konwertującego angiotensynę (ACE) oraz mechanizmów niezależnych od ACE. Strzałki poziome przedstawiają działania później odkrytego ACE2
Odkrycie ACE2 wprowadza nowy stopień złożoności w postrzeganiu układu renina-angiotensyna. ACE2 jest karboksypeptydazą, która katalizuje przekształcanie Ang II w Ang 1-7 oraz Ang I w Ang 1-9 (ryc. 1).1,2,17 Nie wiemy, żeby Ang 1-9 wywierała wpływ na naczynia krwionośne, ale może być przekształcana przez ACE w krótszy peptyd, Ang 1-7, który rozszerza naczynia (ryc. 1). Ang I (składająca się z 10 aminokwasów) to peptyd pośredni pozbawiony znanych działań biologicznych. Ang I jest przekształcana w Ang 1-9 (składającą się z dziewięciu aminokwasów) przez ACE2, natomiast ACE przekształca ją w Ang II, składającą się z ośmiu aminokwasów (ryc. 1). Działania ACE2 powinny więc zapobiegać gromadzeniu się Ang II, która ma działanie kurczące naczynia krwionośne, oraz prowadzić do powstawania Ang 1-7, która działa naczyniorozkurczowo.
ACE i ACE2 mogą wywierać przeciwstawne działania, ściśle regulując szybkość wytwarzania i degradacji peptydów Ang. ACE2 charakteryzuje się dużą sprawnością katalityczną przekształcania Ang II w Ang 1-7.17 Wskazuje to na ważną rolę ACE2 jako mechanizmu zapobiegającego gromadzeniu się Ang II, a jednocześnie zwiększającego wytwarzanie Ang 1-7. Ostatnio wykazano, że Ang 1-7 hamuje fosforylację kinazy aktywowanej przez mitogeny (MAPK) następującą pod wpływem Ang II w komórkach cewek bliższych w nerkach.18 Wytwarzanie Ang 1-7 przez ACE2 w cewkach bliższych mogłoby więc również odgrywać rolę jako mechanizm równoważący działania miejscowo wytwarzanej Ang II.18
Degradację Ang II do Ang 1-7 pod wpływem ACE2 udokumentowano w badaniach, w których wykorzystywano preparaty kory nerek lub izolowane cewki bliższe.19-21 Stwierdzono, że powinowactwo ACE2 do Ang II przekształcanej w Ang 1-7 jest zasadniczo większe niż powinowactwo do Ang I przekształcanej w Ang 1-9.19-21 W świeżo wypreparowanych segmentach cewek bliższych u szczurów Li i wsp.22 obserwowali jednak zależne od ACE2 wytwarzanie Ang 1-7 z Ang I, które obejmowało przekształcenie Ang I w Ang 1-9, a następnie trawienie Ang 1-9 przez ACE z wytworzeniem Ang 1-7. Autorzy innego badania dotyczącego tkanki serca stwierdzili, że ACE2 może działać przeciwstawnie do ACE za pośrednictwem Ang 1-9 zamiast Ang 1-7.23

Tabela 1. Sekwencje aminokwasowe i miejsca hydrolizy peptydów metabolizowanych przez enzym konwertujący angiotensynę typu 2
Wiedza na temat peptydów będących biologicznymi substratami ACE2 jest przydatna jako źródło wstępnych danych dotyczących swoistości działania tej proteazy oraz fizjologicznej roli ACE2. Jeżeli ACE2 jest „enzymem konwertującym” podobnie jak ACE, to efektem jego aktywności jako peptydazy jest wytwarzanie lub degradacja peptydów wykazujących aktywność biologiczną.17 Poznanie biologicznej aktywności substratów i produktów ACE2 dostarcza więc informacji na temat prawdopodobnych fizjologicznych funkcji ACE2.17 Biologicznie aktywne peptydy będące substratami trawionymi przez ACE2 przedstawiono w tabeli 1. Choć głównymi znanymi substratami ACE są peptydy Ang I i Ang II, ACE2 również może hydrolizować kilka innych peptydów. ACE2 nie trawi bradykininy, ale inaktywuje zarówno des-Arg9-bradykininę, jak i lys-des-Arg9-bradykininę.17
ACE2 może również odłączać C-końcową resztę od cząsteczki apeliny i innych peptydów naczynioaktywnych, takich jak neurotensyna, kinetensyna (peptyd pokrewny neurotensynie) i des-Arg-bradykinina.10 ACE2 charakteryzuje się dużą katalityczną wydajnością hydrolizy peptydów apeliny-13 i apeliny-36.10 Apelina zwiększa kurczliwość mięśnia sercowego i zmniejsza napięcie naczynioruchowe.10 Dwa peptydy opioidowe, dynorfina A i β-kazomorfina, także są substratami ACE2.10,17 Te dwa peptydy pobudzają receptory opioidowe κ i δ sprzężone z białkami G i mogą wywierać negatywny wpływ na kurczliwość kardiomiocytów.10
Metody oznaczania aktywności ACE2
Opracowano kilka metod oznaczania aktywności ACE2 w tkankach. W piśmiennictwie opisano zastosowanie w tym celu różnych technik, w tym wysokowydajnej chromatografii cieczowej (HPLC),24 spektrometrii masowej20,22 i fluorymetrii.16,23,25-27 W metodach opartych na HPLC i spektrometrii masowej wykorzystuje się endogenny substrat peptydowy (Ang II) i dzięki nim uzyskuje informacje na temat poszczególnych peptydów powstających w wyniku reakcji hydrolizy. Zaletą metod z wykorzystaniem fluorogennych substratów peptydowych jest możliwość prostej, szybkiej i wygodnej ilościowej oceny tkankowej aktywności ACE2 w wielu próbkach jednocześnie.16
Obecnie najczęściej stosowane metody pomiaru aktywności ACE2 opierają się na wykorzystaniu fluorogennych substratów peptydowych Mca-YVADAPK(Dnp) lub Mca-APK(Dnp).16,23,25-27 W tych oznaczeniach substrat peptydowy zawiera fluorescencyjną grupę 7-metoksykumaryny (Mca), której świecenie zanika po przeniesieniu energii na cząsteczkę 2,4-dinitrofenylu (Dnp). Reakcja ta jest oparta na trawieniu wiązania amidowego między grupą fluorescencyjną a grupą wygaszającą świecenie, co powoduje zwiększenie fluorescencji.28 Metodę tę można wykorzystywać do pomiaru aktywności ACE2 i innych peptydaz.28
Sygnał fluorescencji Mca-YVADAPK(Dnp) jest częściowo wygaszany przez swoiste inhibitory zarówno ACE, jak i ACE2, natomiast takiego efektu nie wywołuje inhibitor innej metaloproteazy, karboksypeptydazy A.16 Wykorzystaliśmy to podwójne działanie w celu opracowania metody umożliwiającej jednoczesne oznaczanie aktywności ACE i ACE2.16 Kombinacja swoistych inhibitorów ACE i ACE2 wygaszała sygnał fluorescencji niemal całkowicie i w takim samym stopniu jak kwas etylenodiaminotetraoctowy (EDTA – związek chelatujący jony metali), co wskazuje na to, że oba metaloenzymy – ACE i ACE2 – uczestniczą w degradacji substratu. Jak zauważono wyżej, podwójne trawienie tego substratu przez ACE i ACE2 umożliwia jednoczesny pomiar aktywności tych dwóch karboksypeptydaz w próbkach tkanek.16 Jest to szczególnie ważne, ponieważ ACE2 i ACE występują razem w wielu tkankach, w których wykazano aktywność katalityczną obu tych enzymów.29 Ocena aktywności ACE2, jedynego czynnego homologu ACE, w połączeniu z oceną aktywności ACE jest przydatna w badaniach nad rolą układu renina-angiotensyna w patofizjologii różnych stanów chorobowych.14
Aktywność ACE2 mierzono również za pomocą innego substratu fluorogennego – Mca-APK(Dnp).25-27 Tą metodą wykrywano aktywność ACE2 w próbkach osocza uzyskanych od myszy charakteryzujących się nadmierną ekspresją ACE2 (ale nie w przypadku myszy typu dzikiego),26 a także w tkance serca szczura25 i w jądrach szczura.27 Posługując się tym substratem w tkankach mysich, nie byliśmy jednak w stanie wygasić fluorescencji za pomocą inhibitora ACE2, MLN-4760. Co więcej, Mca-APK(Dnp) jako substrat jest wysoce wybiórczy dla ACE226 i w związku z tym nie można go wykorzystywać do jednoczesnych pomiarów aktywności ACE i ACE2.
Ferrario i wsp.24 do pomiaru aktywności ACE2 w błonach komórek serca zastosowali metodę opartą na HPLC, a później rozszerzono jej zastosowanie na oznaczenia w innych tkankach i płynach ciała.21 Metoda jest dwuetapowa: najpierw inkubuje się z ACE2 substraty peptydowe znakowane izotopem promieniotwórczym, a następnie wykorzystuje się HPLC do rozdziału produktów aktywności tego enzymu. Metoda oparta na HPLC wykorzystuje zdolność ACE2 do hydrolizowania Ang II z wytworzeniem Ang 1-7.17 Szybkość przekształcania endogennej Ang II znakowanej izotopem promieniotwórczym w Ang 1-7 w obecności inhibitora ACE2 lub przy jego braku jest wskaźnikiem aktywności enzymatycznej ACE2.24 Ponieważ ta metoda wymaga zastosowania HPLC, proces oznaczania jest stosunkowo czasochłonny, ale bezpośrednio dostarcza informacji na temat powstawania Ang 1-7.