Tylko do 29 stycznia bilet na kongres Akademii po Dyplomie NEUROLOGIA kupisz w niższej cenie! Skorzystaj z oferty >
Takie urządzenia zmniejszają umieralność także w prewencji pierwotnej w wybranej grupie pacjentów wysokiego ryzyka. Ryzyko nagłego zgonu najlepiej ocenić na podstawie obniżonej funkcji lewej komory. W drugim badaniu Multicenter Automatic Defibrillator Implantation Trial (MADIT II) (ryc. 3) wykazano, że w porównaniu z klasycznym leczeniem farmakologicznym wszczepienie kardiowertera-defibrylatora chorym z chorobą wieńcową i frakcją wyrzutową lewej komory ≤30% obniżało śmiertelność po 20 miesiącach o 5,6% (spadek ryzyka względnego o 28%).30 Do badania Sudden Death in Heart Failure Trial (SCD-HeFT) rekrutowano chorych w klasie NYHA II lub III niewydolności serca, u których z powodu niedokrwiennej lub innej choroby serca frakcja wyrzutowa lewej komory wynosiła ≤35%.48 W trakcie pięcioletniej obserwacji wszczepialne kardiowertery-defibrylatory obniżały śmiertelność w porównaniu z amiodaronem (28,9% v. 34,1%) i standardowym leczeniem farmakologicznym (28,9% v. 35,8%) (ryc. 4). Amiodaron nie okazał się skuteczniejszy niż standardowa farmakoterapia.48 Metaanalizy również potwierdziły lepsze wskaźniki przeżycia z wszczepionym kardiowerterem-defibrylatorem u pacjentów z kardiomiopatią pochodzenia innego niż niedokrwienna.49
Chorych do leczenia tą metodą należy jednak dobierać indywidualnie. Nie powinno się do niego kwalifikować pacjentów z poważnymi schorzeniami współistniejącymi, przy których szanse na przeżycie roku są niewielkie; nie odniosą oni korzyści z wszczepienia urządzenia, a mogą ucierpieć z powodu działań niepożądanych związanych z tego rodzaju terapią. Podobnie jest z pacjentami w podeszłym wieku. Choć sam wiek nie jest bezwzględnym przeciwwskazaniem do tej formy leczenia, to jednak często występujące choroby współistniejące mogą znacząco wpływać na oczekiwaną długość życia, stąd konieczność indywidualizacji wskazań do takiego leczenia w tej grupie pacjentów.50
W tabeli 2 zebrano niektóre częstsze, zatwierdzone wskazania do wszczepienia kardiowertera-defibrylatora, zarówno w pierwotnej, jak i wtórnej profilaktyce nagłego zgonu, przygotowane na podstawie wytycznych Centers for Medicare and Medicaid Services z 2005 r.
Wskazania do zastosowania takiego leczenia jako metody prewencji pierwotnej opierają się głównie na pomiarach frakcji wyrzutowej lewej komory; wszczepienie jest wskazane tylko w przypadkach, gdy frakcja wyrzutowa jest zmniejszona przez dłuższy czas i są niewielkie szanse na jej poprawę. Zaleca się ponowną ocenę funkcji lewej komory w kilka tygodni po ostrym zawale serca lub rewaskularyzacji wieńcowej albo kilka miesięcy po pierwszym rozpoznaniu kardiomiopatii pochodzenia innego niż niedokrwienna.
Przezskórna ablacja w częstoskurczu komorowym
Ablacja przezskórna może pomóc kontrolować nawroty częstoskurczu komorowego bez działań niepożądanych związanych z przyjmowaniem leków antyarytmicznych. Nic dziwnego, że odgrywa znaczącą rolę w leczeniu niemal wszystkich postaci monomorficznego częstoskurczu komorowego, które nawracają i nie poddają się leczeniu farmakologicznemu.
Idiopatyczny częstoskurcz komorowy
U pacjentów z objawowym idiopatycznym częstoskurczem komorowym ablacja przezskórna jest rozsądnym wyjściem w sytuacji, gdy ani β-adrenolityki, ani antagoniści kanałów wapniowych nienależący do grupy pochodnych dihydropirydyny nie działają albo ich stosowanie jest przeciwwskazane. Jeśli częstoskurcz komorowy bierze swój początek w rejonie drogi odpływu, ablacja jest skuteczna u 80-90% pacjentów.
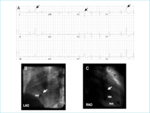
Rycina 5. Elektrokardiogramy ukazujące przedwczesne skurcze komorowe, których źródło znajduje się w pierścieniu aortalnym. Pacjent cierpiał z powodu przedwczesnych skurczów komorowych dających poważne objawy oraz z powodu samoistnie wygasających epizodów częstoskurczu komorowego o takiej samej morfologii zapisu.
Na rycinie 5 znajdują się rentgenogramy i elektrogramy pacjenta z idiopatycznym częstoskurczem komorowym zaczynającym się w drodze odpływu. Niepowodzenie ablacji często wynika z niemożności wywołania częstoskurczu w celu ustalenia jego źródła. W 10-20% przypadków bierze swój początek poza drogą odpływu prawej komory, w wypustkach miokardium wokół pierścienia aorty, tętnicy płucnej i osierdzia oraz pierścienia zastawki mitralnej. Ablacja w tych miejscach może być trudniejsza technicznie, a czasami może ją uniemożliwiać bliskość tętnicy wieńcowej. Sukces osiąga się u ponad 80% pacjentów.47,51,52 Powikłania po zabiegu występują rzadko, ale mogą obejmować perforację z tamponadą oraz – przy zabiegu w obrębie osierdzia lub ujścia aorty – występujące rzadko zamknięcie tętnic wieńcowych.
Coraz częściej uznaje się, że bardzo częste idiopatyczne częstoskurcze komorowe lub przedwczesne skurcze komorowe mogą upośledzać czynność komór, prowadząc do kardiomiopatii spowodowanej tachykardią. W niektórych przypadkach upośledzenie czynności lewej komory może być efektem technicznego błędu wynikającego z trudności pomiaru wydolności w sytuacji bardzo częstych niemiarowości. Mimo to usunięcie niemiarowości może w znaczącym stopniu poprawić wydolność komór serca.53
Częstoskurcz komorowy zależny od blizny pozawałowej w uszkodzonym sercu
Ablacja przezskórna ma znaczenie w zapobieganiu lub redukcji częstości częstoskurczów komorowych związanych z niedokrwieniem u pacjentów z obecną blizną pozawałową.54 Może ratować życie chorym z ustawicznym częstoskurczem komorowym. Dla nowszych procedur odsetek skutecznych zabiegów waha się od 50% do 80%, a odsetek poważnych działań niepożądanych – od 2% do 10%.55-58 Umieralność związana z zabiegiem wynosi ok. 3%, przy czym większość zgonów to wynik niepowodzenia zabiegu, czyli nieopanowania częstych, zagrażających życiu częstoskurczów komorowych. Ablacja pozwala też kontrolować nawracające częstoskurcze komorowe u chorych z kardiomiopatią rozstrzeniową, naciekową chorobą serca (taką jak sarkoidoza) lub arytmogenną dysplazją prawej komory. W tych schorzeniach ablacja jest często trudniejsza niż w przypadku, gdy częstoskurcz komorowy ma źródło w przebytym zawale serca. Obszary zbliznowaciałe i pętle pobudzeń nawrotnych są częściej zlokalizowane podosierdziowo lub śródściennie, co wymaga mapowania i ablacji w obrębie osierdzia. W długim okresie obserwacji postęp choroby jest prawdopodobnie czynnikiem zwiększającym częstość nawrotów częstoskurczu komorowego.59-62
Dokładniejsza identyfikacja ośrodka arytmii, który jest źródłem częstoskurczu komorowego, stała się możliwa dzięki metodom pozwalającym rozpoznać na „potencjałowej mapie serca” blizny jako obszary niskiej amplitudy elektrografu. Jest to jednak możliwe tylko podczas stabilnego rytmu zatokowego. Dzięki takim anatomicznym rekonstrukcjom, w czasie gdy serce pacjenta bije miarowo, można dokonać precyzyjnej ablacji wyłącznie zmienionych obszarów miokardium z nadzieją, że uda się ograniczyć ryzyko uszkodzenia zdrowego mięśnia. Takie podejście, znane pod nazwą mapowania substratowego, pozwala przeprowadzić zabieg ablacji także w przypadku częstoskurczów komorowych niestabilnych hemodynamicznie, ale mapowanie w trakcie samego częstoskurczu jest niemożliwe.
Niepowodzenie ablacji przy częstoskurczu komorowym wynika często z przyczyn anatomicznych. Częstoskurcz komorowy może mieć źródło w obszarze podosierdziowym lub położonym śródściennie. Blizny osierdziowe są częste zwłaszcza w kardiomiopatiach pochodzenia innego niż niedokrwienne, ale można je też zaobserwować u pacjentów po zawałach lub przy arytmogennej dysplazji prawej komory. By opanować tego rodzaju niemiarowości, można wprowadzić cewnik mapujący i ablacyjny do osierdzia z dojścia podmostkowego. Takie postępowanie jest konieczne u ok. 10% pacjentów z nawracającym częstoskurczem komorowym kierowanych na ablację do naszego ośrodka. Należy zachować ostrożność, by nie dokonać ablacji w pobliżu tętnicy wieńcowej.
U pacjentów z wszczepionym kardiowerterem-defibrylatorem wystąpienie epizodu częstoskurczu komorowego stanowi czynnik podwyższonego ryzyka niewydolności serca i zgonu, mimo że sam epizod został skutecznie przerwany dzięki wszczepionemu urządzeniu. Tachykardia komorowa może też być wskaźnikiem zachodzącego procesu przebudowy komór. Nie jest pewne, czy działania podejmowane celem zapobiegania lub zmniejszenia liczby epizodów częstoskurczu komorowego u chorych z wszczepionym kardiowerterem-defibrylatorem poprawiają rokowanie. Dlatego w niedawnym badaniu chorych z wszczepionym kardiowerterem-defibrylatorem przydzielono losowo bądź do wykonania ablacji na podstawie mapowania substratowego, bądź do leczenia zachowawczego.63 Podczas obserwacji u 128 pacjentów ablacja zmniejszała liczbę samoistnych epizodów częstoskurczu komorowego (12% v. 33% zapadalność na niemiarowości komorowe wymagające leczenia kardiowerterem-defibrylatorem; p=0,007). Badanie nie miało wystarczającej mocy statystycznej, by ocenić śmiertelność, ale dostrzeżono pozytywny trend w kierunku zmniejszenia śmiertelności w grupie poddanej ablacji.
Polimorficzny częstoskurcz komorowy
Nawracający polimorficzny częstoskurcz komorowy jest spotykany rzadziej niż monomorficzny. Występuje u pacjentów z zespołem Brugadów, zespołem wydłużonego QT i u nielicznych chorych z idiopatycznym migotaniem komór. W rzadkich przypadkach nawrotowego polimorficznego częstoskurczu komorowego zapoczątkowywanego przez przedwczesne skurcze komorowe i ich eliminacja za pomocą ablacji może doprowadzić do likwidacji nawracającego polimorficznego częstoskurczu komorowego. Ogniska pobudzeń często znajdują się w układzie włókien Purkiniego lub w drodze odpływu prawej komory.
Podsumowanie
Częstoskurcz komorowy jest ważną przyczyną nagłych zgonów. Ryzyko, a co za tym idzie, schemat leczenia zależą od rodzaju choroby serca leżącej u źródeł zaburzeń rytmu. Częstoskurcz komorowy najczęściej towarzyszy chorobie niedokrwiennej serca lub innym postaciom anatomicznych zmian w sercu związanych z ryzykiem nagłego zgonu. Rozpoznano wiele grup chorych, u których wzrasta ryzyko nagłego zgonu i którzy mogą odnieść korzyść z wszczepienia kardiowertera-defibrylatora. Bardzo ważne jest, by odróżnić pacjentów wysokiego ryzyka od tych z idiopatycznym częstoskurczem komorowym bez strukturalnych zmian w sercu, u których rokowanie jest pomyślniejsze.
