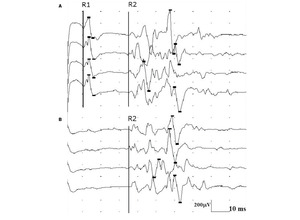
Rycina 4. Prawidłowe odpowiedzi R1 i R2 odruchu mrugania uzyskane stymulacją nerwu nadoczodołowego lewego.
Odruch H umożliwia ocenę przewodzenia w proksymalnych odcinkach badanego nerwu. Pobudza się włókna czuciowe Aα kończące się synapsami pobudzającymi na neuronach ruchowych rdzenia kręgowego. Pobudzenie motoneuronów α daje odpowiedź odruchową z mięśnia rejestrowaną jako fala H. Wylicza się następnie szybkość przewodzenia odruchu H. U dorosłych odruch ten można uzyskać przez pobudzenie włókien czuciowych nerwu pośrodkowego i odbiór odpowiedzi z mięśnia zginacza promieniowego nadgarstka lub pobudzenie włókien czuciowych nerwu piszczelowego i odbiór odpowiedzi z mięśnia trójgłowego łydki. W praktyce badanie to jest wykorzystywane do oceny zaburzeń przewodzenia w korzeniach L5 i S1.8,9
Odruch mrugania składa się z części aferentnej utworzonej przez włókna czuciowe nerwu trójdzielnego i części eferentnej utworzonej przez włókna ruchowe nerwu twarzowego. Badanie wykonuje się najczęściej, stymulując nerw nadoczodołowy i odbierając odpowiedź z mięśni okrężnych oka. W odruchu mrugania analizuje się latencje odpowiedzi wczesnej R1 po stronie drażnionej i odpowiedzi późnych R2 – obustronnie. (ryc. 4). Odpowiedź R1 powstaje przez pobudzenie głównego jądra nerwu trójdzielnego w moście po stronie stymulacji. Nie towarzyszy jej mrugnięcie oka. Odpowiedź R2 przewodzona jest drogami polisynaptycznymi. Impulsy tworzące odpowiedź R2 zstępują do jądra rdzeniowego nerwu V. Na poziomie rdzenia przedłużonego część impulsów przechodzi na stronę przeciwną i następnie obustronnie wstępują one do jąder nerwu VII na poziomie mostu. Odpowiedzi R2 towarzyszy mrugnięcie oka. W przypadku uszkodzenia czuciowych włókien obwodowych nerwu V odpowiedzi R1 i R2 mogą w ogóle nie wystąpić lub latencje wszystkich odpowiedzi są opóźnione. Jeśli uszkodzone jest jądro główne nerwu V, odpowiedzi R1 się nie rejestruje. Przy uszkodzeniu jądra rdzeniowego nerwu V załamki R2 natomiast nie występują lub są opóźnione. Należy pamiętać, że uszkodzenia nadnamiotowe ośrodkowego układu nerwowego mogą mieć wpływ na wydłużenie latencji rejestrowanych odpowiedzi odruchu mrugania.7-9
Mikroneurografia włókien czuciowych
Mikroneurografia daje możliwość zarejestrowania aktywności pojedynczych włókien czuciowych różnych grubości po umieszczeniu w skórze mikroelektrod. Ich średnica wynosi zaledwie 100-200 μm. Metoda ta służy głównie do badania niezmielinizowanych włókien czuciowych typu C i włókien autonomicznych. Może być przydatna w diagnostyce neuropatii z tzw. objawami dodatnimi. Z powodu skomplikowanej metodyki badania mikroneurografia jest częściej wykorzystywana w badaniach naukowych m.in. w celu zrozumienia patofizjologii hiperalgezji i polineuropatii bólowych.3,9,10
Ilościowe badanie czucia
Metody ilościowego badania czucia (quantitative sensory testing, QST) mogą być cennym i nieinwazyjnym uzupełnieniem badania ENG. Obejmują badanie czucia przewodzonego włóknami o różnym stopniu mielinizacji. W rutynowym badaniu ocenia się zwykle progi czucia wibracji, ciepła, zimna, bólu związanego z odczuwaniem gorąca i zimna (tab. 1). Badanie polega na wielokrotnej stymulacji receptorów określonych rodzajów modalności bodźcami o różnym natężeniu według określonego algorytmu. Obecnie najczęściej stosuje się metodę kroków 4, 2, 1 z dodatkowym zastosowaniem zerowego bodźca. Jest ona dość szybka, ale ponieważ wielokrotnie przekracza się próg bodźca, nie zaleca się jej przy ocenie progów bólowych. W badaniu progów odczuwania bólu stosuje się metodę limitów. Bodziec jest stopniowo podwyższany do momentu, gdy pacjent zarejestruje go jako bólowy. Badanie wszystkich modalności w co najmniej dwóch miejscach może trwać ponad 2 godziny.11
To stosunkowo proste badanie ma sporo ograniczeń. Na wynik istotny wpływ ma współpraca pacjenta. Brakuje jednoznacznych wyników dotyczących powtarzalności tej metody. Najlepszą powtarzalność uzyskano dla oceny progu wibracji. QST nie lokalizuje uszkodzenia. Może ono dotyczyć zarówno obwodowego, jak i ośrodkowego układu nerwowego. Badanie to jest mało dostępne.11-13
Z klinicznego punktu widzenia QST wraz z biopsją może być przydatne w diagnostyce polineuropatii cienkich włókien o nieznanej etiologii. U pacjentów z hiperalgezją może służyć udokumentowaniu tych zaburzeń.3,11-13
Somatosensoryczne potencjały wywołane
Somatosensoryczne potencjały wywołane (somatosensory evoked potential, SEP) powstają na różnych odcinkach obwodowych i ośrodkowych szlaków czucia głębokiego pod wpływem drażnienia obwodowych włókien czuciowych bodźcem elektrycznym. W praktyce klinicznej ocenia się potencjały o krótkiej latencji. Przy stymulacji kończyn górnych pojawiają się one po około 30 ms, a przy drażnieniu nerwów obwodowych kończyn dolnych – po około 50 ms. SEP lokalizują poziom patologii i niekiedy sugerują typ uszkodzenia. Przy znacznym spadku amplitudy załamków sugerują ubytek włókien, a przy wydłużeniu latencji – uszkodzenie demielinizacyjne.
Badanie wykonuje się najczęściej w pozycji leżącej. Elektroda stymulująca przyłożona jest do nerwu obwodowego i drażni go bodźcem o niewielkim natężeniu (na granicy pobudzenia włókien ruchowych). Bodziec elektryczny jest zadawany z częstotliwością 3-6 Hz. W celu rejestracji potencjałów konieczne jest zastosowanie metody uśredniania 1000-2000 pobudzeń. Podczas stymulacji za pośrednictwem kilku elektrod wcześniej ustawionych nad szlakami czuciowymi odbiera się jednoczasowo potencjały wywołane generowane z różnych okolic. Badanie trzeba wykonać dwukrotnie, by upewnić się, że uzyskane odpowiedzi się powtarzają.
Nazwy załamków oznacza się zwykle literą i liczbą. Litera oznacza, w którą stronę wychylony jest załamek (N od negative – do góry, P od positive – do dołu). Liczba informuje, jaką latencję ma zwykle załamek.
W badaniu SEP podczas stymulacji nerwu pośrodkowego ocenia się najczęściej latencje załamków: N9 – generowanego w punkcie Erba, N13 – powstającego w rogach tylnych rdzenia szyjnego, N18 – w jądrze brzusznym tylnym wzgórza, N20 – w zakręcie zaśrodkowym, P25 – generowanego w korowych włóknach kojarzeniowych. Następnie wylicza się ośrodkowy czas przewodzenia (latencja N20 – latencja N13).9,14
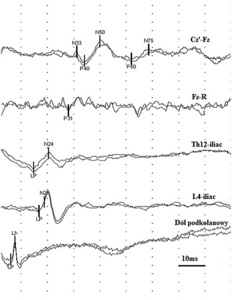
W badaniu SEP stymulacją nerwu piszczelowego analizuje się zwykle latencje załamków: N8 (LN) – generowanego w dole podkolanowym, N24 – powstającego na poziomie Th12, P31 – we wstędze przyśrodkowej, P40 – na powierzchni przyśrodkowej zakrętu zaśrodkowego (główny potencjał czuciowy) oraz N50 i N75 – generowanych przez korowo-korowe włókna kojarzeniowe (ryc. 5).9,15
SEP są przydatne w lokalizacji uszkodzenia szlaków czuciowych. Obustronne wykonanie badania w kończynach górnych i dolnych prawidłowo lokalizuje uszkodzenie. Wówczas jednak rejestracja SEP może trwać nawet ponad dwie godziny. SEP wykonuje się też w celu udokumentowania uszkodzenia szlaków czuciowych towarzyszących zespołom niedoborowym (np. witamina B12), chorobom metabolicznym (np. zespół mocznicowy) i chorobom neurodegeneracyjnym (np. adrenoleukodystrofia). Badanie to znajduje zastosowanie w monitorowaniu śródoperacyjnym funkcji rdzeniowych. SEP są pomocne w rozpoznaniu mioklonii pochodzenia korowego występujących m.in. w padaczce mioklonicznej – uzyskuje się wówczas charakterystyczny olbrzymi potencjał korowy.16 Obecnie coraz rzadziej wykonuje się badanie SEP w wątpliwych przypadkach u osób z podejrzeniem stwardnienia rozsianego, co wynika ze zmian kryteriów rozpoznania tej choroby.
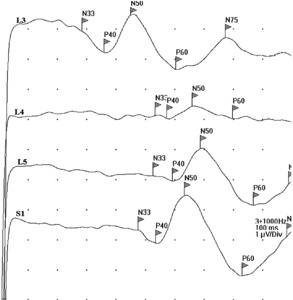
Rycina 6. Badanie DSEP wykazało uszkodzenie na poziomie korzeni czuciowych L4 i L5 po stronie lewej.