Dążymy do celu
Nocna napadowa hemoglobinuria – od teorii do praktyki klinicznej
Dr n. med. Piotr Boguradzki
Lek. Alicja Hoffman
NNH (PNH – paroxysmal nocturnal hemoglobinuria) to rodzaj rzadkiej niedokrwistości hemolitycznej, która klinicznie manifestuje się hemolizą wewnątrznaczyniową, różnego stopnia niewydolnością szpiku oraz tendencją do żylnej i tętniczej zakrzepicy.[1] Jest wynikiem niezłośliwego klonalnego rozrostu wielopotencjalnych komórek krwiotwórczych (WKK), które nabyły defekt syntezy kotwicy glikozylofosfatydyloinozytolowej (GPI) we własnej błonie komórkowej. Defekt ten prowadzi do braku wielu białek powierzchniowych na WKK, m.in. odpowiedzialnych za ochronę własnych komórek organizmu przed układem dopełniacza. Choć defekt dotyczy wszystkich komórek krwi, największe znaczenie kliniczne ma hemoliza erytrocytów spowodowana niekontrolowaną aktywnością dopełniacza. NNH często występuje z niewydolnością szpiku, głównie z anemią aplastyczną. Choroba najczęściej dotyka młodych dorosłych – mediana zachorowania w populacji dorosłych wynosi 30 lat. NNH może mieć ciężki przebieg kliniczny, a 5-letnie przeżycie wynosi 35 proc. Zakrzepica jest główną przyczyną zgonów w przebiegu NNH.[1] W Polsce co roku diagnozuje się ok. 20 nowych przypadków NNH. Szacowana częstość występowania NNH na świecie to 1,3/milion/rok, co wskazuje na znaczne niedodiagnozowanie NNH w naszym kraju.[1] Dlatego ważne jest zwiększanie świadomości lekarzy na temat tego schorzenia oraz częstsze kierowanie chorych na badania.
PATOGENEZA
Układ dopełniacza (UD)
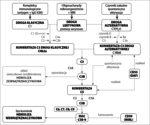
Układ dopełniacza jest bardzo ważnym elementem obrony przeciwzakaźnej i razem z komórkami żernymi należy do najstarszych ewolucyjnie mechanizmów odporności organizmu.[1] Obejmuje ponad 60 białek błonowych i rozpuszczalnych, które są aktywowane w określonej kolejności poprzez reakcje łańcuchowe proteaz.
Istnieją trzy drogi aktywacji dopełniacza (ryc. 1):
- klasyczna,
- lektynowa,
- alternatywna.
Wszystkie trzy prowadzą do produkcji konwertazy C3. Konwertaza C3 jest odpowiedzialna za rozpad C3 na składową C3a i C3b. C3a pełni funkcję anafilotoksyny, a C3b łączy się z błoną komórki docelowej, tworząc konwertazę C5, która rozkłada C5 na składowe C5a i C5b. C5b przyłącza kolejno składniki C6, C7, C8. W wyniku przyłączenia cząsteczek C9 do kompleksu C5b678 powstaje kompleks atakujący błonę (MAC – membrane attacking complex), prowadzący do lizy komórki. Inicjacja drogi klasycznej i lektynowej wymaga odpowiednio połączonych z antygenem przeciwciał klasy IgG lub IgM, lub białka wiążącego mannozę związanego z oligosacharydami na powierzchni mikroorganizmów. Na drodze alternatywnej zarówno składowa C3, jak i konwertaza C3 drogi alternatywnej mają zdolność do samoistnej aktywacji.
Rola UD w patogenezie NNH została potwierdzona w 1954 roku przy okazji odkrycia alternatywnej drogi aktywacji dopełniacza. Odpowiada ona za 80-90 proc. całej aktywności dopełniacza,[1] dlatego niezbędne są mechanizmy regulujące jego aktywność, które zabezpieczają komórki własne organizmu przed jego spontanicznym działaniem. Z punktu widzenia patogenezy NNH najważniejsze błonowe czynniki regulujące UD to: CR1 (kofaktor dla czynnika I rozkładającego C4b i C3b), CD55 (DAF – decay accelerating factor – przyspiesza rozkład konwertazy C3 i C5) i CD59 (MIRL – membrane inhibitor of reactive lysis – wiąże C8 i C9 i hamuje formowanie MAC).
CD55 i CD59 są umocowane w błonie przez kotwicę z GPI (ryc. 2), co umożliwia im większą ruchomość w błonie komórkowej i efektywniejsze działanie. Zaburzenia w syntezie kotwicy GPI powodują brak/zmniejszenie ekspresji CD55 i CD59 na powierzchni komórek potomnych WKK z defektem syntezy kotwicy (erytrocyty, trombocyty, monocyty i granulocyty) oraz spontaniczną niekontrolowaną aktywację układu dopełniacza. Jedynym błonowym regulatorem dopełniacza w komórkach NNH pozostaje CR1. Brak CD59 skutkuje niekontrolowanym powstawaniem MAC i w konsekwencji hemolizą wewnątrznaczyniową. Brak CD55 prowadzi do zwiększonej opsonizacji erytrocytów przez fragmenty dopełniacza, głównie C3b. Opłaszczone erytrocyty są wychwytywane przez układ siateczkowo-śródbłonkowy i niszczone w mechanizmie hemolizy zewnątrznaczyniowej. U nieleczonych pacjentów w obrazie klinicznym dominują jednak objawy hemolizy wewnątrznaczyniowej, które maskują toczący się równolegle proces hemolizy zewnątrznaczyniowej.[1]
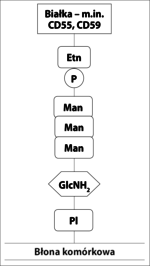
Ryc. 2. Budowa kotwicy GPI. Kotwica jest zbudowana z połączonego z błoną komórkową fosfatydyloinozytolu (PI), glukozaminy (GlcNH2), trzech cząsteczek mannozy (Man) i fosfoetanolaminy (PEtn).
Genetyka
W latach 90. XX wieku zidentyfikowano mutację genu PIG-A (Phosphatidylinositolglycan class A), która odpowiada za defekt syntezy kotwicy GPI.[1] NNH jest spowodowana nabytą (somatyczną) mutacją genu PIG-A, zlokalizowanym na Xp22 (ryc. 3). To jedyna niedokrwistość hemolityczna zależna od nabytej mutacji somatycznej komórek macierzystych szpiku[1] oraz pierwszy poznany przykład schorzenia nabytego, związanego z chromosomem X.[1] Produkt genu PIG-A odpowiada za wczesne etapy syntezy kotwicy GPI, która zachodzi posttranslacyjnie w siateczce endoplazmatycznej. Mutacja PIG-A skutkuje utratą funkcji genu, a w konsekwencji brakiem kotwicy GPI w błonie komórkowej i brakiem wielu białek powierzchniowych kotwiczonych za jej pomocą. PIG-A to jedyny zidentyfikowany dotychczas gen odpowiedzialny za fenotyp NNH (defekt GPI).
Z nabywania mutacji przez WKK oraz lokalizacji genu PIG-A na chromosomie X wynika[9]: