Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Kiedy neutropenia wymaga aspiracyjnej biopsji szpiku?
Powtarzający się całkowity brak neutrofilów we krwi obwodowej lub obecność pojedynczych segmentów, mimo dobrego stanu dziecka, jest wskazaniem do biopsji szpiku, oceny toru dojrzewania linii granulocytarnej i w ten sposób wykluczenia agranulocytozy wrodzonej, gdzie zahamowanie dojrzewania linii granulocytarnej występuje na wczesnym etapie dojrzewania – promielocytu/mielocytu.3 Jest to charakterystyczny obraz szpiku dla ciężkiej wrodzonej agranulocytozy, w której nie obserwuje się wzrostu liczby granulocytów w okresie zakażeń. Stan ten wymaga pilnej interwencji (leczenie czynnikiem wzrostu granulocytów, rHuG-CSF, a w przypadku braku odpowiedzi na leczenie konieczne jest przeszczepienie szpiku). Natomiast w AIN zahamowanie dojrzewania występuje na późnym etapie rozwoju linii granulocytarnej – pałki, zwykle obecne są też pojedyncze segmenty.2,3
Stężenie autoprzeciwciał przeciwko neutrofilom w diagnostyce AIN
Obecność przeciwciał potwierdza rozpoznanie AIN, jednak ich brak jej nie wyklucza. Według danych z piśmiennictwa obecność autoprzeciwciał w AIN stwierdza się jedynie u 38-70% dzieci z AIN.2 Tak więc określenie stężenia przeciwciał może nie być badaniem rozstrzygającym o rozpoznaniu AIN.
Leczenie szpitalne
W rzadkich przypadkach przebieg zakażeń u dzieci z AIN jest poważny, obserwuje się słaby wyrzut granulocytów do krwi obwodowej, wówczas do antybiotyków o szerokim zakresie działania należy dodać rHuG-CSF. Stosowanie preparatów gammaglobulin w dawce 1-2 g/kg m.c. daje umiarkowany rezultat.
Profilaktyka zakażeń u dzieci z AIN
W profilaktyce zakażeń u dzieci z AIN:
• Stosuje się szczepienia obowiązkowe i zalecane, szczególnie obejmujące bakterie otoczkowe: Haemophilus influenzae typu b, Streptococcus pneumoniae oraz Neisseria meningitidis
• Szczepi się żywymi szczepionkami wtedy, gdy liczba neutrofilów >1000/μl.
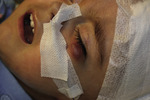
Rycina 1. Uogólnione zakażenie prątkiem Mycobacterium bovis i M. tuberculosis o fatalnym przebiegu u dziecka z ciężkim złożonym niedoborem odporności.
• Profilaktyka antybiotykowa dotyczy głównie dzieci do 1 roku życia z klinicznymi objawami zakażeń, również z gorączkami o niejasnej przyczynie. W zapobieganiu zakażeniom stosuje się amoksycylinę – 20 mg/kg/24 h lub fenoksymetylopenicylinę 2 razy 250 000 j./24 h, lub cefaklor 20 mg/24 h.
Limfopenia w rozmazie krwi obwodowej
Niemowlę/małe dziecko, u którego w rozmazie krwi obwodowej obserwuje się powtarzające zmniejszenie odsetka i bezwzględnej liczby limfocytów, a także występują niepokojące objawy kliniczne, powinno być niezwłocznie skierowane do poradni lub na oddział immunologii.
Do niepokojących objawów klinicznych wskazujących na ciężki złożony niedobór odporności należą:
• Zahamowanie rozwoju dziecka, szczególnie brak przyrostu masy ciała, często z objawami towarzyszącej biegunki
• Ciężkie zakażenia narządowe lub uogólnione, takie jak zapalenie płuc, mózgu, kości, wątroby
• Najczęstsze przyczyny zakażeń: Pneumocystis jiroveci, wirus cytomegalii, wirus Epsteina-Barr, Candida sp., Aspergillus oraz prątek szczepionkowy BCG (ryc. 1)
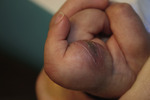
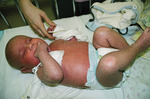
• Erytrodermia (ryc. 2) lub inne niewyjaśnione zmiany skórne mogące wskazywać na ciężki niedobór odporności