Pomiary stężeń leków dotyczą najczęściej wartości minimalnych (Cssmin) oznaczanych w stanie stacjonarnym, czyli tuż przed podaniem kolejnej dawki leku. Osiągnięcie stanu stacjonarnego następuje po upływie 4-6 wielokrotności biologicznego okresu półtrwania (t0,5) leku. Na przykład u dzieci biologiczny okres półtrwania kwasu walproinowego wynosi średnio 10 h, więc stan stacjonarny ustala się po 40 h, natomiast u niemowląt t0,5 karbamazepiny wynosi 20±11 h, więc jej stężenie osiąga stan stacjonarny po 80 h.2
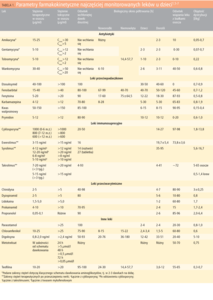
Kryteria monitorowania leków u dzieci są takie same jak u dorosłych, ale w postępowaniu tym może odgrywać ważną rolę kilka dodatkowych czynników. Z jednej strony prowadzenie skutecznej i bezpiecznej farmakoterapii u dzieci wymaga poznania i zrozumienia dynamiki zmian fizjologicznych i biochemicznych zachodzących podczas rozwoju w organizmie dziecka, szczególnie w pierwszym roku życia, z drugiej zaś strony – poznania ich wpływu na farmakokinetykę leków. Po podaniu zazwyczaj stosowanych dawek wpływ ten może skutkować nasileniem lub osłabieniem działania farmakologicznego oraz częstszym występowaniem działań niepożądanych lub toksycznych. Wielokrotnie obserwowane u dzieci międzyosobnicze zróżnicowanie procesów farmakokinetycznych, znacznie większe niż u dorosłych, stanowi istotne wskazanie do indywidualizacji dawkowania leków.1,3,4 W tabeli 1 podano przykłady leków często monitorowanych u dzieci, zakresy ich stężeń terapeutycznych oraz wartości podstawowych parametrów farmakokinetycznych.1,5-7
Interpretacja stężeń leków
Interpretacja stężeń leków oznaczonych w materiale biologicznym u wcześniaków, noworodków i dzieci jest inna, szczególnie w pierwszych 18 miesiącach życia, czyli w okresie najbardziej dynamicznego rozwoju czynności wielu narządów. Długi okres półtrwania niektórych leków u niemowląt jest przyczyną późnego osiągania stanu równowagi (np. teofilina 3-12 dni, fenobarbital 8-15 dni, karbamazepina 2-4 dni).1 Należy pamiętać, że u dzieci zachodzi także możliwość zmiany farmakokinetyki leku w czasie trwania terapii. Często schemat dawkowania, ustalony w pierwszych dniach stosowania leku, może się zmienić po pewnym czasie leczenia.10 Ponadto brakuje dostatecznej liczby badań farmakologicznych i farmakokinetycznych przeprowadzonych z udziałem dzieci, co powoduje, że wiedza na ten temat jest ograniczona, a postępowanie w tym zakresie utrudnione. Prowadzenie TMD jest szczególnie wskazane na oddziałach intensywnej terapii noworodka. Jest to spowodowane tym, że podczas hospitalizacji wcześniakom o masie ciała poniżej 1000 g może być podawanych 15-20 leków, a wcześniakom o masie ciała powyżej 2500 g zwykle 4-10.1
Do najważniejszych różnic fizjologicznych między organizmem dziecka a dorosłego należą:
• Zmniejszona zdolność wydzielania kwasu żołądkowego u noworodków (pH 6-8), a zwłaszcza wcześniaków, mogąca prowadzić do zmian we wchłanianiu wielu leków.1 Przykładem jest erytromycyna lub benzylopenicylina (penicylina G), leki o charakterze słabych zasad wykazujące większą dostępność biologiczną u noworodków w porównaniu do starszych dzieci i dorosłych.8
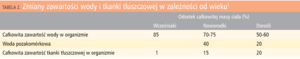
• Zwiększona zawartość wody w przestrzeni zewnątrzkomórkowej oraz wody całkowitej w stosunku do masy ciała noworodka lub dziecka w połączeniu ze zmniejszoną zawartością tkanki tłuszczowej. Jest to przyczyną większej niż u dorosłych objętości dystrybucji leków rozpuszczalnych w wodzie i mniejszej leków rozpuszczalnych w tłuszczach (tab. 2).1 Przykładem są antybiotyki aminoglikozydowe, których objętość dystrybucji jest większa u niemowląt w porównaniu do dorosłych. Wartość tego parametru dla gentamycyny mieści się u noworodków i niemowląt w granicach 0,5-1,2 l/kg m.c., podczas gdy u dorosłych wynosi 0,2-0,3 l/kg m.c.9 Zmniejszona zawartość tkanki tłuszczowej u noworodków w porównaniu do dorosłych powoduje, że objętość dystrybucji diazepamu wynosi w tej grupie 1,4-1,8 l/kg m.c., natomiast u dorosłych 2,2-2,6 l/kg m.c.10
• Zmiany dotyczące białek osocza mogą wpływać na dystrybucję i eliminację leków, zwłaszcza silnie wiążących się z tymi białkami. U noworodków i małych dzieci zdolność wiązania leków z białkami osocza jest znacznie zmniejszona w porównaniu z dorosłymi, np. diazepam wiąże się w 84% (u dorosłych w 99%), propranolol 60% (93%), fenytoina 74-90% (90%).2 Przyczyną tego może być zmniejszone stężenie białek we krwi i zmniejszona zdolność wiązania leków przez te białka, a także mniejsze powinowactwo białek do leków oraz niższe pH surowicy.1
• Niedojrzałość układu mikrosomalnego enzymów wątroby do 3 miesiąca życia, powodująca wolniejszą biotransformację leków u noworodków i niemowląt. Aby więc w tych grupach wiekowych osiągnąć stężenia terapeutyczne, należy podawać mniejsze dawki leków w przeliczeniu na masę ciała.1
• Zmniejszony całkowity klirens leków u noworodków i niemowląt, szczególnie u wcześniaków, spowodowany niedostateczną dojrzałością czynnościową wątroby i nerek.1
• Większa niż u dorosłych aktywność układu mikrosomalnego enzymów wątroby u dzieci w okresie dojrzewania, co wymaga stosowania większych dawek niektórych leków, aby osiągnąć stężenia we krwi podobne jak u dorosłych.1
Prowadzenie TDM u dzieci, znajomość odrębności anatomii i fizjologii ich rozwoju, a także wiedza o leku, stanie klinicznym chorego i wynikach badań biochemicznych wpływają na optymalizację terapii, co przez indywidualizację dawkowania leków istotnie przyczynia się do zwiększenia skuteczności i bezpieczeństwa leczenia.1 Poniżej omówiono monitorowanie wybranych grup leków.
Antybiotyki aminoglikozydowe
Do najczęściej stosowanych antybiotyków aminoglikozydowych u niemowląt i dzieci należą gentamycyna, amikacyna i tobramycyna. Wskazaniem do monitorowania stężeń tych leków we krwi jest ich wąski współczynnik terapeutyczny i znaczne różnice międzyosobnicze w wartościach stężeń po podaniu zwykle stosowanych dawek, a także ich duża oto- i nefrotoksyczność. Ma to szczególne znaczenie w przypadku długotrwałego stosowania lub równoczesnego podawania z innymi lekami mogącymi nasilać ich działanie toksyczne.2,11
Działanie bakteriobójcze antybiotyków aminoglikozydowych zależy od wartości stężenia maksymalnego we krwi (Cmax) oraz pola pod krzywą stężenie-czas (AUC0-24). Jest ono tym większe, im bardziej Cmax i AUC0-24 przewyższają minimalne stężenie hamujące wzrost bakterii (MIC). Parametrami farmakokinetyczno-farmakodynamicznymi (PK/PD), korelującymi ze skutecznością leczenia, są w tym przypadku wielkość stosunku Cmax/MIC oraz AUC0-24/MIC, których optymalne wartości wynoszą odpowiednio 8-10 oraz ok. 125.2,11 Zapewnienie optymalnych wartości tych parametrów w praktyce klinicznej oznacza maksymalizację dawek (podawanych raz lub dwa razy na dobę) w stosunku do MIC patogenu wywołującego zakażenie.
Większa zawartość płynu zewnątrzkomórkowego u noworodków, niemowląt i dzieci w stosunku do masy ciała jest przyczyną większej objętości dystrybucji aminoglikozydów. W związku z tym u dzieci zmieniają się omówione wcześniej parametry PK/PD, gdyż zwiększenie objętości dystrybucji powoduje zmniejszenie Cmax i przy danej wrażliwości szczepu również zmniejsza się stosunek Cmax/MIC. Może to prognozować brak skuteczności leczenia. Z uwagi na trudną do przewidzenia objętość płynów pozakomórkowych należy bezwzględnie oznaczać w surowicy dzieci stężenie antybiotyków aminoglikozydowych oraz podawać większe dawki w przeliczeniu na jednostkę masy ciała niż u dorosłych.2,11