Korzyści płynące z prowadzenia terapii monitorowanej u dzieci leczonych lekami immunosupresyjnymi dotyczą wydłużenia czasu przeżycia biorcy przeszczepu oraz ograniczenia występowania działań niepożądanych. Ponadto prowadzenie TDM podczas stosowania tych leków ogranicza koszty związane z występowaniem epizodów ostrego odrzucenia przeszczepu. Konieczna jest więc znajomość farmakokinetyki tych leków i możliwość monitorowania ich stężenia we krwi.16
Digoksyna
Digoksyna należy do najdłużej monitorowanych leków. Czynniki, które kwalifikują ten lek do monitorowania stężeń we krwi u dzieci, obejmują: wąski współczynnik terapeutyczny, często śmiertelne powikłania po stosowaniu preparatów naparstnicy, liczne interakcje digoksyny z innymi lekami, występowanie istotnej korelacji między stężeniem digoksyny we krwi a stężeniem w mięśniu sercowym i działaniem leku, zmienność farmakokinetyki tego leku w zależności od stanu klinicznego chorego oraz trudności w ocenie przedawkowania leku.2
Metotreksat
Metotreksat jest lekiem przeciwnowotworowym, którego stężenie u dzieci zdecydowanie zaleca się monitorować, stosując rutynowe oznaczanie we krwi lub płynie mózgowo-rdzeniowym. Wskazaniem do monitorowania stężeń metotreksatu jest leczenie dużymi dawkami tego leku (HD-MTX) z jednoczesnym schematem podawania folinianu wapnia, współistnienie niewydolności nerek, wątroby lub obecność płynu wysiękowego w jamach ciała, a także równoczesne podawanie innych leków nasilających jego toksyczność (np. fenytoina, antybiotyki aminoglikozydowe). 1,2
Metotreksat jest lekiem toksycznym, przy czym wykazano zależność między jego stężeniem we krwi i czasem ekspozycji na lek a nasileniem objawów toksycznych. Działanie osłonowe przed toksycznym działaniem metotreksatu polega na podawaniu folinianu wapnia (wg schematu), gdy stężenie metotreksatu po 24, 48 i 72 h od chwili rozpoczęcia wlewu przekracza odpowiednio wartości 5, 0,5 i 0,05µmol/l (tab. 1).1,2
Ryzyko wystąpienia działania toksycznego po podaniu dużych dawek metotreksatu, współistnienie innych chorób oraz możliwość interakcji z wieloma lekami sprawiają, że monitorowanie jego stężenia we krwi powinno być działaniem rutynowym. Oznaczanie stężeń metotreksatu u każdego chorego pozwala lekarzowi dobrać odpowiednie dawki folinianu wapnia oraz ustalić optymalny czas jego odstawienia.2
Teofilina
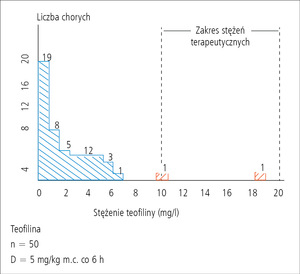
Rycina. Stężenia subterapeutyczne, terapeutyczne i potencjalnie toksyczne teofiliny we krwi 50 dzieci chorych na astmę przyjmujących lek w dawce 5 mg/kg m.c. co 6 h.20
Teofilina jest silnie działającym lekiem przeciwastmatycznym o wąskim współczynniku terapeutycznym. Istnieje dobrze udokumentowana zależność między jej stężeniem we krwi a działaniem leczniczym i toksycznym. Do najważniejszych czynników wpływających na zmianę parametrów farmakokinetycznych teofiliny u małych dzieci należy zaliczyć ich wiek. Na przykład u noworodków biologiczny okres półtrwania teofiliny waha się od 24 do 30 h, u dzieci w wieku 1-9 r.ż. wynosi 3-4 h, a u dorosłych ponownie się wydłuża (3,6-12 h). Duża zmienność farmakokinetyki teofiliny sprawia, że bez monitorowania jej stężeń we krwi trudno osiągnąć u dzieci pożądane działanie lecznicze.1,19 Przykładem mogą być wyniki badań, w których wykazano, że po zwyczajowym dawkowaniu teofiliny (5 mg/kg m.c. co 6 h) u 50 dzieci chorych na astmę jedynie u dwojga stężenia osiągnęły wartości terapeutyczne, mieszczące się w zakresie 10-20 µg/ml. U pozostałych dzieci stężenia były subterapeutyczne, w tym u 19 nie wykryto obecności tego leku we krwi mimo deklarowanego leczenia przez opiekunów (rycina).20
Podsumowanie
TDM odgrywa istotną rolę w pediatrii, gdyż pozwala na racjonalny dobór dawki leku oparty na kryteriach farmakokinetycznych i klinicznych, a przez to na uniknięcie pozornej terapii lub nasilenia działań niepożądanych. Z tego względu w ostatnich latach znacznie zwiększyła się liczba prac dotyczących farmakokinetyki leków u dzieci. Zrozumienie wpływu dynamiki rozwoju dziecka na procesy wchłaniania, dystrybucji i eliminacji leku oraz na jego działanie może w znacznym stopniu przyczynić się do skuteczności i bezpieczeństwa leczenia w tej populacji chorych. Czynnikami ułatwiającymi wprowadzenie tej metody postępowania do praktyki klinicznej było zastosowanie nowoczesnych i czułych technik analitycznych, a także obliczeń farmakokinetycznych opartych na farmakokinetyce populacyjnej, która może ułatwić szersze wprowadzenie tej metody postępowania do praktyki klinicznej. Szczegółowe omówienie tych zagadnień przekracza ramy niniejszego opracowania.1,2