Odległe następstwa wcześniactwa związane z układem oddechowym
lek. Wojciech Durlak
dr hab. n. med. Przemko Kwinta, prof. UJ
Przewlekłe powikłania związane z układem oddechowym stanowią jedną z najważniejszych grup niekorzystnych następstw wcześniactwa. Wśród nich najpoważniejszym schorzeniem jest dysplazja oskrzelowo-płucna.
Wprowadzenie
Wcześniactwo definiuje się jako urodzenie przed 37 tygodniem trwania ciąży. Częstość jego występowania w krajach rozwiniętych wynosi 5-10%. Zgodnie z najnowszymi danymi w Polsce wskaźnik ten wynosi 6,3%; w Stanach Zjednoczonych jest wyższy – ok. 11,5%. Wyniki badań epidemiologicznych dowodzą, że nasilenie odległych następstw wcześniactwa jest odwrotnie proporcjonalne do wieku płodowego i stopnia niedojrzałości w chwili urodzenia.
Układ oddechowy – obok układu nerwowego – jest najbardziej narażony na rozwój odległych powikłań związanych z porodem przedwczesnym. W wyniku takiego porodu dochodzi do przerwania prawidłowego rozwoju płuc, co niekorzystnie wpływa na możliwość utrzymania odpowiedniej wymiany gazowej po urodzeniu i wymusza konieczność stosowania wsparcia oddechowego.
Jednym z głównych powikłań wcześniactwa dotyczących układu oddechowego jest dysplazja oskrzelowo-płucna (BPD – bronchopulmonary dysplasia), która jest najczęstszą przewlekłą chorobą układu oddechowego wieku niemowlęcego. Obecnie do jej rozwoju dochodzi przede wszystkim u dzieci urodzonych przed 28 tygodniem ciąży – występuje nawet u 2/3 z nich. Zidentyfikowano liczne czynniki ryzyka rozwoju BPD, do których, poza wiekiem płodowym, zaliczamy: toksyczność tlenu, uraz związany ze stosowaniem inwazyjnej wentylacji mechanicznej, stan zapalny czy zakażenie. Mimo licznych badań nie udało się dotychczas jednoznacznie określić roli czynników genetycznych w jej rozwoju. Obraz kliniczny jest zmienny i obejmuje stałe nieprawidłowości stwierdzane w badaniu przedmiotowym (cechy duszności, zjawiska osłuchowe – świsty, rzężenia, trzeszczenia). U dzieci z ciężką postacią dochodzi także do rozwoju przewlekłej niewydolności oddechowej. Opieka nad dzieckiem z dysplazją oskrzelowo-płucną wymaga zaangażowania wielospecjalistycznego zespołu złożonego z pediatry, pulmonologa, dietetyka, anestezjologa, pielęgniarki. Kluczowym elementem leczenia jest prewencja zakażeń układu oddechowego oraz ograniczenie ekspozycji na substancje szkodliwe, np. dym tytoniowy, zanieczyszczenia powietrza. Istnieje także możliwość stosowania swoistej biernej immunoprofilaktyki, której celem jest ograniczenie ryzyka ciężkiego przebiegu zakażenia syncytialnym wirusem oddechowym (RSV) u niemowląt z dysplazją oskrzelowo-płucną.
Celem niniejszej pracy jest omówienie najważniejszych odległych następstw wcześniactwa dotyczących układu oddechowego, ze szczególnym uwzględnieniem dysplazji oskrzelowo-płucnej oraz podkreśleniem metod diagnostycznych i terapeutycznych posiadających udowodnioną skuteczność w postępowaniu z dziećmi urodzonymi przedwcześnie.
Rozwój układu oddechowego
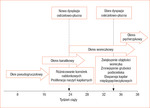
Rycina 1. Związek między dysplazją oskrzelowo-płucną a etapami rozwoju układu oddechowego (opracowanie własne na podstawie pozycji piśmiennictwa 1)
Rozwój osobniczy układu oddechowego dzieli się na 5 etapów: zarodkowy (3-7 tydzień ciąży), rzekomogruczołowy (7-17 tydzień ciąży), kanalikowy (17-27 tydzień ciąży), woreczkowy (27-37 tydzień ciąży) oraz pęcherzykowy (po 37 tygodniu ciąży). Prześledzenie etapów prenatalnego rozwoju układu oddechowego pozwala na lepsze zrozumienie patogenezy odległych powikłań płucnych wynikających z przedwczesnego porodu (ryc. 1).1
Faza zarodkowa rozpoczyna się w 3 tygodniu, kiedy z brzusznej części jelita przedniego powstaje uchyłek, z którego następnie rozwijają się tchawica, oskrzela i mniejsze drogi oddechowe. Jednocześnie rozpoczyna się rozwój tkanki łącznej, mięśni, chrząstek i krążenia płucnego. Podczas fazy rzekomogruczołowej dochodzi do dynamicznego podziału przewodzącej części układu oddechowego, w wyniku którego powstaje 17 generacji oskrzeli. Między 17 a 27 tygodniem ciąży w fazie kanalikowej dochodzi do rozwoju obwodowych części płuc. Powstają oskrzeliki końcowe, oddechowe oraz woreczki końcowe, intensywnie dojrzewa mikrokrążenie płucne. W tej fazie rozpoczyna się również produkcja surfaktantu. Podczas fazy woreczkowej odbywa się dalsze dojrzewanie przestrzeni oddechowych, ścieńczeniu ulega bariera pęcherzykowo-włośniczkowa.
Po urodzeniu układ oddechowy dalej się rozwija. Dochodzi wówczas do stopniowego zwiększania zarówno wymiaru pęcherzyków płucnych, jak i ich liczby. Szacuje się, że liczba pęcherzyków w chwili urodzenia odpowiada 1/3-1/2 liczby u dorosłego i szybko się zwiększa w pierwszych dwóch latach życia, osiągając liczbę 100-200 milionów po tym okresie. Liczba pęcherzyków osiąga docelową wartość w wieku 8-10 lat. W kolejnych latach zwiększa się ich rozmiar. Całkowita pojemność życiowa płuc u noworodka wynosi ok. 50 ml/kg m.c., zaś u osoby dorosłej ok. 60-70 ml/kg m.c.
Dysplazja oskrzelowo-płucna
Definicja
Zgodnie z obecnie obowiązującą definicją rozpoznanie dysplazji oskrzelowo-płucnej można ustalić u dziecka, które wymaga tlenoterapii przez ≥28 dni po porodzie. Natomiast określenie stopnia nasilenia choroby opiera się na kryteriach, które zaproponowali Jobe i Bancalari (tab. 1).2 Zgodnie z nimi postać łagodną rozpoznaje się u dzieci, które w 36 tygodniu wieku, licząc od daty ostatniej miesiączki, nie wymagają tlenoterapii; umiarkowaną u tych, które wymagają stosowania tlenu w stężeniu <30%; zaś ciężką u dzieci wymagających stosowania tlenu w stężeniu >30% lub dodatniego ciśnienia.
Epidemiologia
Dane dotyczące częstości występowania dysplazji oskrzelowo-płucnej są zróżnicowane. Najprawdopodobniej wynika to ze stosowania różnych definicji choroby oraz odzwierciedla różnice w praktyce klinicznej w poszczególnych ośrodkach. Wyniki dużych badań epidemiologicznych sugerują, że kryteria rozpoznania choroby spełnia 42-68% dzieci urodzonych przed 28 tygodniem ciąży i z bardzo małą urodzeniową masą ciała (<1500 g).3 Jednocześnie należy zaznaczyć, że aż 97% chorych spełniających kryteria rozpoznania choroby stanowią dzieci urodzone z masą ciała <1250 g. Ryzyko rozwoju BPD jest odwrotnie proporcjonalne do wieku płodowego i masy urodzeniowej. Stwierdzono, że rozwija się ona u ok. 70% dzieci urodzonych w 24 tygodniu ciąży i tylko u ok. 23% urodzonych w 28 tygodniu trwania ciąży. Uważa się, że choroba rozwija się zgodnie z jednym z trzech wzorców. W pierwszej grupie od urodzenia dochodzi do rozwoju ciężkiej niewydolności oddechowej, wymagającej przedłużonego stosowania wentylacji mechanicznej. Taki obraz kliniczny dotyczy przede wszystkim dzieci, których matki nie otrzymały glikokortykosteroidów przed porodem. W drugiej grupie dzieci obserwuje się zaburzenia oddychania, które cofają się po zastosowaniu leczenia, a następnie od ok. 3 tygodnia życia ponownie nasilają. Taki przebieg jest typowy dla dzieci, u których dochodzi do rozwoju zakażenia lub występuje przetrwały przewód tętniczy. Trzecią grupę stanowią noworodki, u których po urodzeniu obserwuje się łagodne zaburzenia oddychania nasilające się stopniowo. Dotyczy to dzieci z ciąż powikłanych zakażeniem błon płodowych lub zakażonych patogenami atypowymi (np. Chlamydia, Ureaplasma).