Patogeneza i czynniki ryzyka
Rozwój dysplazji oskrzelowo-płucnej jest uwarunkowany wieloczynnikowo. Wśród czynników ryzyka zidentyfikowano udział zarówno czynników genetycznych, prenatalnych, jak i postnatalnych.
Najważniejszym czynnikiem ryzyka pozostaje wcześniactwo.4 W badaniach kohortowych wykazano, że rozwijające się płuca są najbardziej podatne na uszkodzenie prowadzące do rozwoju choroby między 23 a 32 tygodniem ciąży. Wówczas charakteryzują się one niedojrzałością strukturalną zrębu, niedoborem surfaktantu, zmniejszoną podatnością i niewydolnością mechanizmów odpowiedzialnych za usuwanie aktywnych rodników tlenowych. Wykazano także, że zahamowanie wzrastania wewnątrzmacicznego stanowi niezależny czynnik ryzyka rozwoju dysplazji u dzieci urodzonych przedwcześnie.
Kolejnym ważnym czynnikiem ryzyka rozwoju BPD jest wentylacja mechaniczna.5 Stosowanie agresywnego wsparcia oddechowego z wykorzystaniem dużych objętości oddechowych prowadzi do urazu objętościowego (tzw. volutraumy). W ramach prewencji należy zatem dążyć do stosowania możliwie małych objętości oddechowych i nieinwazyjnego wsparcia oddechowego dodatnim ciśnieniem.
Udowodniono, że toksyczność tlenu również przyczynia się do rozwoju dysplazji oskrzelowo-płucnej. Konieczność stosowania tlenu w dużym stężeniu wynikająca z niedojrzałości czynnościowej układu oddechowego oraz słabsza aktywność mechanizmów odpowiedzialnych za rozkład aktywnych rodników tlenowych u dzieci urodzonych przedwcześnie sprzyjają pogłębianiu się uszkodzenia rozwijających się płuc.
Wyniki badań obserwacyjnych sugerują, że kolejnym ważnym czynnikiem ryzyka rozwoju BPD jest zakażenie. Wykazano, że ekspozycja na czynniki infekcyjne (chorioamnionitis) w okresie prenatalnym wiąże się z 2-3-krotnie większym ryzykiem rozwoju dysplazji. Dużą rolę w rozwoju dysplazji oskrzelowo-płucnej przypisuje się okołoporodowej kolonizacji Ureaplasma urealyticum. Wykazano, że u dzieci, u których stwierdza się obecność tej bakterii, ryzyko rozwoju choroby jest 2-3-krotnie większe. Choroba rozwija się również częściej u dzieci, u których po porodzie stwierdzano zakażenie uogólnione. Zaobserwowano także, że zwiększone stężenie cytokin prozapalnych i czynników chemotaktycznych wiąże się z ryzykiem rozwoju choroby.
Mimo licznych badań nie udało się jednoznacznie ustalić wpływu czynników genetycznych na rozwój BPD.6,7 W badaniach prowadzonych na bliźniętach stwierdzono większą częstość występowania choroby u obojga bliźniąt monozygotycznych w porównaniu z bliźniętami dwuzygotycznymi. Sugeruje to znaczny udział czynników genetycznych w jej rozwoju. Zidentyfikowano polimorfizmy w genach kodujących m.in. nabłonkową syntazę tlenku azotu (eNOS)8 oraz czynnika wzrostu śródbłonka naczyniowego (VEGF),9 które wiążą się ze zwiększonym ryzykiem rozwoju choroby. W większości badań nie udało się wykazać jednoznacznego związku badanych polimorfizmów z ryzykiem wystąpienia dysplazji oskrzelowo-płucnej. Badano w nich między innymi geny białek surfaktantu, dysmutazy ponadtlenkowej, receptorów toll-like,10 TNF,11 TGF-β12.
Obraz kliniczny
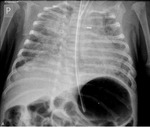
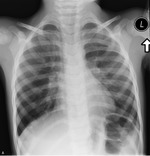
Rycina 2. RTG klatki piersiowej 2-miesięcznego niemowlęcia z ciężką postacią dysplazji oskrzelowo-płucnej
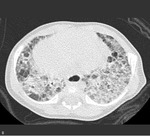
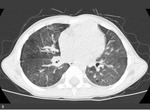
Objawy u dzieci z BPD są zmienne. U niemowląt można zaobserwować tachypnoe i zaznaczone cechy wzmożonego wysiłku oddechowego, takie jak zaciąganie przestrzeni międzyżebrowych. Bardzo często nawet u dziecka, które nie ma cech ostrej infekcji, stwierdza się stałe zmiany osłuchowe o typie rzężeń, trzeszczeń oraz świstów,1 dlatego bardzo ważne jest zachowanie ciągłości opieki nad dzieckiem z dysplazją, aby uniknąć niepotrzebnego zlecania badań dodatkowych czy włączania leczenia. Podobnie interpretując obraz radiologiczny klatki piersiowej u dziecka z dysplazją oskrzelowo-płucną, należy odnieść go do poprzednio wykonywanych badań, aby uwzględnić utrwalone zmiany radiologiczne (ryc. 2 i 3).
Leczenie
Opieka nad dzieckiem, u którego rozpoznano BPD, może być realizowana w wielu różnych miejscach (gabinet lekarza podstawowej opieki zdrowotnej, ambulatoryjna opieka specjalistyczna, szpital, a w wybranych przypadkach także hospicjum) w zależności od stopnia nasilenia objawów oraz innych powikłań wynikających z wcześniactwa. Nadrzędnymi celami postępowania lekarskiego są: ograniczenie dalszego uszkodzenia płuc, łagodzenie objawów oraz zapewnienie dziecku najlepszych możliwości rozwoju i wzrastania.
Leczenie niefarmakologiczne
Dzieci z dysplazją oskrzelowo-płucną, u których dochodzi do największego uszkodzenia płuc, mogą wymagać przedłużonej wentylacji mechanicznej. Parametry wentylacji powinny być tak dobrane, aby zminimalizować proces uszkadzania rozwijającej się tkanki płucnej. Najczęściej stosuje się dodatnie końcowowydechowe ciśnienie wartości 4-6 cm H2O. Dzieci, których płuca wykazują niehomogenność wentylacji, odnoszą korzyść z zastosowania wydłużonego czasu wdechu. Każde dziecko wymagające przewlekłej wentylacji mechanicznej powinno być monitorowane przy użyciu pulsoksymetru, zaś okresowo należy wykonywać badanie gazometryczne. Warto zaznaczyć, że u pacjentów, u których dochodzi do rozwoju przewlekłej niewydolności oddechowej, akceptuje się nieco wyższe wartości pCO2 (45-55 mmHg). Zależność od wentylacji mechanicznej stanowi jedno ze wskazań do założenia tracheostomii. Nie określono jednoznacznie wieku, w którym powinno się kwalifikować chorych do tego zabiegu. Z reguły najwcześniej rozważa się jego wykonanie u dzieci, które dorastają do terminu fizjologicznego porodu. Przedmiotem dyskusji pozostaje docelowe wysycenie hemoglobiny tlenem, jakie należy zapewnić dzieciom z BPD, które wymagają przedłużonej wentylacji mechanicznej. Po dorośnięciu do terminu fizjologicznego porodu zaleca się utrzymanie saturacji na poziomie ≥95%.1
Bardzo ważnym elementem postępowania z dzieckiem chorym na dysplazję oskrzelowo-płucną jest odpowiednie żywienie. Wykazano, że u tych dzieci znacznie częściej dochodzi do zahamowania wzrastania (nawet u 60%). Przyczyniają się do tego takie czynniki, jak zwiększone zapotrzebowanie energetyczne, przewlekła hipoksja, zmniejszona skuteczność karmienia związana z osłabionym mechanizmem ssania. Zalecana podaż kalorii u niemowląt z BPD wynosi ok. 150 kcal/kg/24 h, zaś białka 3,5-4 g/kg/24 h. Najlepszym źródłem pożywienia jest pokarm naturalny, należy jednak pamiętać o konieczności jego wzbogacania (wzmacniacz pokarmu kobiecego, maltodekstryny, suplement białka). Jest to szczególnie ważne, ponieważ u dzieci z dysplazją oskrzelowo-płucną należy dążyć do ograniczenia podaży płynów – do 140-150 ml/kg/24 h u dzieci z umiarkowaną postacią choroby i nawet 110-120 ml/kg/24 h u chorych z ciężką postacią. Takie postępowanie zapobiega obrzękowi płuc i zapewnia skuteczniejszą wymianę gazową. U dzieci, u których ogranicza się podaż płynów, może być konieczne zmodyfikowanie sposobu przyrządzania mieszanki przez zwiększenie jej stężenia.
Leczenie farmakologiczne
W leczeniu przewlekłym dzieci z dysplazją oskrzelowo-płucną zwyczajowo stosuje się leki z trzech grup – diuretyki, glikokortykosteroidy, leki rozszerzające oskrzela.
W piśmiennictwie nie ma dowodów na odległe korzyści ze stosowania diuretyków w leczeniu BPD. Wykazano, że ich podanie doraźnie korzystnie wpływa na mechanikę oddychania oraz oksygenację.13 Nie ma jednak dowodów na to, że ich przewlekłe stosowanie wpływa na odległe rokowanie czy czas wentylacji mechanicznej. W praktyce stosuje się diuretyki tiazydowe (hydrochlorotiazyd w dawce 2 mg/kg/24 h doustnie, spironolakton w dawce 1 mg/kg/24 h doustnie) lub pętlowe (furosemid w dawce 1 mg/kg/24 h dożylnie lub 2 mg/kg/24 h doustnie). Należy jednak pamiętać o działaniach niepożądanych obu grup leków – furosemid może wywoływać zaburzenia elektrolitowe, zwiększa wydalanie wapnia z moczem, co przyczynia się do rozwoju nefrokalcynozy i osteopenii wcześniaczej. W przypadku diuretyków tiazydowych działania niepożądane są zwykle mniej nasilone, ale mogą obejmować hipokaliemię, hiponatremię, alkalozę hipokaliemiczną.