Oprócz termoablacji prądem o wysokiej częstotliwości istnieją też inne metody ablacji termicznej guzów wątroby: mikrofalowa, laserowa i ultradźwiękowa.
Do termoablacji można kwalifikować guzy o średnicy ≤6 cm. Jest to związane z ograniczeniami technicznymi dotyczącymi strefy ablacji oraz wpływem rozległej martwicy tkanek wątroby na organizm chorego. Liczba zmian nowotworowych wątroby nie powinna przekraczać 5. Do tej metody kwalifikuje się chorych z nieoperacyjnymi pierwotnymi guzami wątroby – najczęściej w przebiegu zaawansowanej marskości (stopień C w skali Childa-Pugha). Termoablacja prądem o wysokiej częstotliwości ma szerokie zastosowanie ze względu na możliwość jej wykonania bez zabiegu operacyjnego i znieczulenia ogólnego u chorych obarczonych dużym ryzykiem operacyjnym. Metoda ta charakteryzuje się małą śmiertelnością (0-0,5%), niewielką liczbą powikłań, skutecznością w leczeniu zmian nieoperacyjnych, krótkim okresem hospitalizacji oraz stosunkowo małym kosztem wykonania zabiegu. Ryzyko krwawienia jest nieduże dzięki efektowi hemostatycznemu koagulacji tkanek. Liczba powikłań się zwiększa, gdy guz jest położony podtorebkowo, a nie w głębi miąższu, szczególnie pod przeponą, w pobliżu jelit, dużych żył i przewodów żółciowych. Możliwe powikłania występują rzadko (4,4-12,7%). Należą do nich: postępująca niewydolność wątroby (zaawansowana marskość wątroby), żółtaczka, oparzenie przewodów wątrobowych z ich zwężeniem, hemobilia, trombocytopenia, porażenna niedrożność jelit i zakrzepica żyły wrotnej.
Alkoholizacja
Ablacja guza nowotworowego wątroby przez podanie absolutnego alkoholu bezpośrednio do zmiany jest rozwiązaniem terapeutycznym przeznaczonym dla chorych z pierwotnym rakiem narządu, którzy nie kwalifikują się do leczenia chirurgicznego.1 Stężony alkohol można wstrzyknąć za pomocą cienkiej igły śródoperacyjnie lub sposobem przezskórnym (PEI – percutaneous alcohol injection). Metodę tę wprowadził Sugiura w 1983 roku jako sposób leczenia nieoperacyjnych ognisk raka wątrobowokomórkowego. Stosowano ją również w próbach niszczenia ognisk przerzutowych. Ponieważ jednak ablacja zmian przerzutowych alkoholem daje tylko 50% całkowicie zniszczonych ognisk, od 1995 roku została całkowicie wyparta przez ablację termiczną. Z powodu nieprzewidywalności rozchodzenia się alkoholu podanego do zmiany tę metodę powinno się wykorzystywać do niszczenia litych, pierwotnych guzów wątroby.
Zarówno ablacja alkoholem, jak i termoablacja wykazują podobną skuteczność w leczeniu guzów o średnicy ≤2 cm z niewielką przewagą termoablacji, jeśli chodzi o długość 4-letniego przeżycia – 57% dla RFA i 47% dla PEI. Po zastosowaniu termoablacji stwierdzono martwicę 96% guzów, a po alkoholizacji odsetek wynosił 86-89%. W badaniu Takayamy leczono alkoholizacją guzy o średnicy ≤3 cm i uzyskano martwicę w 70%. W przypadku guzów ≤5 cm martwicę uzyskano w 50%. Aby osiągnąć pozytywny efekt terapeutyczny, potrzebna jest większa liczba powtórzeń alkoholizacji, natomiast jest ona obarczona mniejszym ryzykiem powikłań.12 Ablację alkoholem często łączy się z miejscową chemioterapią, podczas której podaje się chemioterapeutyk bezpośrednio do naczyń odżywiających guz. Wstrzyknięcie absolutnego alkoholu etylowego bezpośrednio do guza powoduje jego martwicę przez denaturację białek i dehydratację tkanki. Prowadzi to w konsekwencji do zakrzepicy drobnych naczyń w okolicy podania i dalszej martwicy guza. Objętość wstrzykniętego alkoholu powinna stanowić 2/3 objętości guza nowotworowego ocenianego w USG. Pod kontrolą badania ultrasonograficznego wykonuje się wkłucie do zmiany nowotworowej i ocenia jej echogeniczność aż do uzyskania hiperechogeniczności. Wskazaniem do ablacji guza przez podanie stężonego alkoholu etylowego jest obecność dobrze ograniczonego, litego guza o średnicy ≤3 cm, oddalonego od powierzchni wątroby, lub istnienie maksymalnie 3 zmian narządu. Chory nie powinien mieć objawów przewlekłej niewydolności wątroby, żółtaczki ani wodobrzusza. Powikłaniami zastosowanej metody mogą być: wyciek alkoholu do jamy otrzewnej, uszkodzenie naczyń lub przewodów żółciowych, krwawienie, hemobilia, infekcja oraz ból i gorączka w przypadku kontaktu alkoholu z innymi narządami. Mimo zachęcających wyników wstrzyknięcie alkoholu do guza nadal pozostaje paliatywną formą leczenia zaawansowanego pierwotnego raka wątroby.
Krioablacja
Jest to metoda małoinwazyjna i względnie bezpieczna w leczeniu pierwotnych guzów nowotworowych wątroby. Krioablację stosuje się w przypadku guzów o średnicy ≤3 cm w liczbie 1-5. Polega ona na zamrożeniu tkanki nowotworowej, a tym samym spowodowaniu martwicy guza. Leczenie zimnem w terapii chorób nowotworowych sięga 1845 roku, kiedy to James Arnott jako pierwszy zastosował zimno. Pod koniec XX wieku krioterapię zaczęto wykorzystywać w leczeniu guzów narządowych. Jest to alternatywna metoda leczenia HCC u pacjentów spełniających kryteria mediolańskie. Można ją stosować przezskórnie, podczas laparotomii i laparoskopii.
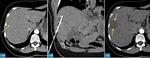
Badania kliniczne potwierdzają, że krioablacja jest stosunkowo bezpieczna, skuteczna i może być łączona z radioterapią, chemioterapią i leczeniem immunologicznym. Ma ona wiele zalet, m.in. możliwość wizualizacji kryształków lodowych, nie powoduje też istotnego uszkodzenia dużych naczyń krwionośnych. W guz nowotworowy wkłuwa się specjalną igłę, przez którą podaje się ciekły azot, argon lub hel. W wyniku tego dochodzi do powstania kuli lodowej (ice ball), którą następnie się rozmraża (ryc. 9). Ten proces zamrażania i rozmrażania, oparty na efekcie Joule’a-Thomsona, powoduje bezpośrednie i pośrednie uszkodzenie komórek, a w konsekwencji – martwicę guza nowotworowego. Efekt Joule’a-Thomsona dotyczy zmiany temperatury gazu podczas jego powolnego rozprężania pod wpływem stałej różnicy ciśnień bez wymiany ciepła z otoczeniem. Współcześnie stosowane aparaty wykorzystują argon do zamrażania, a hel do rozmrażania lub gaz argonowy jednocześnie do obydwu tych czynności. Kiedy temperatura podczas zamrażania spada, tworzą się kryształki lodu wewnątrz i na zewnątrz komórki, zwiększa się wewnątrzkomórkowe ciśnienie osmotyczne, następuje dehydratacja komórki i w konsekwencji uszkodzenie błony komórkowej. Podczas procesu rozmrażania rekrystalizacja lub łączenie się drobnych kryształków lodu prowadzi do powstania większych kryształków, co potęguje uszkodzenie komórki. Krioablacja pośrednio uszkadza komórki nowotworowe przez oddziaływanie na małe naczynia krwionośne – powoduje to uszkodzenie śródbłonka naczyń, zwiększenie ich przepuszczalności i obrzęk śródmiąższowy. Agregacja płytek, zakrzepica i zamknięcie przepływu krwi w drobnych naczyniach prowadzą do niedokrwienia guza, a w rezultacie do jego martwicy.
Na efekt zamrażania wpływa kilka czynników: temperatura, czas zamrażania i rozmrażania oraz liczba cykli. Kula lodowa powiększa się wraz z upływem czasu zamrażania, co pozwala go kontrolować. Wielkość kuli można wizualizować za pomocą USG, TK lub MR13 i monitorować, tak aby zapewnić całkowitą ablację. Temperatura na obwodzie kuli lodowej wynosi 0°C i komórki nowotworowe mogą w niej przeżyć. Z kolei wewnątrz kuli temperatura wynosi od −50 do −20°C i w takich warunkach nowotwór może być zniszczony, dlatego w celu uzyskania całkowitej martwicy guza obwód kuli lodowej powinien o 1 cm przekraczać obwód guza.2
Kolejnym założeniem jest twierdzenie, że im dłuższy czas rozmrażania, tym większy obszar martwicy guza. W przypadku guzów >3 cm pojedyncza igła może nie wystarczyć, dlatego preferowane jest użycie 2 igieł. Gdy w pobliżu guza nie ma większych naczyń, wkłuwa się je w odległości nie większej niż 2 cm od siebie i 1 cm od krawędzi guza. Jeżeli w obrębie guza znajduje się wiele naczyń krwionośnych, najlepiej umieścić 2 igły co najmniej 1 cm od siebie i 5 mm od krawędzi guza.
Do powikłań krioablacji zalicza się: uszkodzenie okrężnicy, zawał mięśnia sercowego, przetokę żółciową, krwawienie, trombocytopenię i koagulopatię.15 Może także wystąpić niewydolność wątroby, ropień wątroby, zespół ostrej niewydolności oddechowej (ARDS – acute respiratory distress syndrome) lub niewydolność nerek. Dlatego podczas krioablacji konieczne jest monitorowanie czynności wątroby, nerek i układu krzepnięcia oraz dokładna lokalizacja zmiany nowotworowej wątroby i zakresu zamrażanego obszaru. Śmiertelność stosowanej metody wynosi do 1,5%.
Techniki ablacji przezskórnej
Minimalnie inwazyjne techniki leczenia ognisk HCC w wątrobie bardzo się rozwinęły w ciągu ostatnich 20 lat. Liczba dostępnych technik znacznie się zwiększyła od czasu, gdy jedyną dostępną metodą była alkoholizacja. Nieustająco prowadzone są badania nad rozwojem dostępnych metod i wprowadzaniem kolejnych. Wynika to z niedoskonałości sposobów leczenia zmian pierwotnych oraz z tego, że systematycznie rośnie zachorowalność na pierwotnego raka wątroby. Skuteczność metod przezskórnego leczenia złośliwych zmian w wątrobie została potwierdzona licznymi badaniami. Zależy ona od lokalizacji zmian i wyraźnie się zmniejsza, im te zmiany są większe. Stwierdzono również, że niepełna ablacja prowadzi do przyspieszenia wzrostu zmiany i zwiększenia oporności na apoptozę.
Żaden z obecnie stosowanych sposobów przezskórnego leczenia nie jest w pełni uniwersalny, dlatego tak istotne znaczenie ma rozwijanie i doskonalenie dostępnych metod. Pacjenci poddawani terapii z wykorzystaniem metod przezskórnych są dyskwalifikowani z zabiegów resekcyjnych. Powodem dyskwalifikacji może być ich stan ogólny, choroby współistniejące, wielkość zmian oraz ich liczba bądź lokalizacja. Dlatego oceniając skuteczność tych metod, należy uwzględniać heterogenność grup pacjentów.
Jedną z najczęściej stosowanych i najdokładniej przebadanych technik jest RFA (ryc. 10), wykorzystująca energię prądu o częstotliwości fal radiowych. Polega ona na termicznym zniszczeniu tkanki otaczającej sondę wprowadzoną do zmiany. Podobnie jak inne metody wykorzystujące wysoką temperaturę RFA ma pewne ograniczenia. Za główny problem należy uznać brak możliwości pełnej ablacji zmiany usytuowanej w sąsiedztwie naczyń krwionośnych o średnicy >3 mm. Przepływ krwi w tych naczyniach jest na tyle duży, że skutecznie odbiera energię cieplną (heat-sink effect). Kolejne ograniczenie to dystans od dróg żółciowych. Zbyt mała odległość (<1 cm) wyraźnie zwiększa ryzyko ich uszkodzenia. Aby uzyskać tak potrzebną w tej metodzie precyzję, sondy do ablacji umieszcza się pod kontrolą USG, często po wcześniejszym mappingu, z zastosowaniem wielorzędowej TK.