Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Na podstawie dotychczasowych badań wydaje się, że sukces transplantacji, jakim jest duży (5-letni) odsetek przeżyć biorcy i brak nawrotu choroby, zależy w głównej mierze od naciekania naczyń przez nowotwór oraz od biologii samego guza. Naciekanie naczyń ma bowiem ścisły związek z jego wielkością i lokalizacją. Można je dokładnie określić za pomocą rozmaitych przedoperacyjnych badań obrazowych lub na podstawie oględzin patomorfologicznych usuniętego narządu. Biologia samego guza nie jest natomiast do końca poznana. Niewątpliwie zależy ona od pochodzenia komórek nowotworowych (stopnia zróżnicowania patomorfologicznego) i ekspresji genów je reprezentujących. W najnowszych doniesieniach podkreśla się rolę biologicznego markera, jakim jest stężenie α-fetoproteiny (AFP) oznaczane przed przeszczepem, którego wartość >100 ng/ml stanowi istotny czynnik ryzyka nawrotu HCC i uzupełnienie rozszerzonych kryteriów.8,9
Kolejnym istotnym problemem, dotyczącym nie tylko chorych z rakiem wątrobowokomórkowym, jest długi czas oczekiwania na operację spowodowany ograniczoną liczbą dawców. W większości przypadków pacjenci czekający na przeszczep są poddawani leczeniu HCC według protokołu transplantacyjnego przyjętego w poszczególnych ośrodkach, aby w tym czasie zahamować rozwój nowotworu. Obecnie najczęściej stosowane techniki to chemoembolizacja (TACE – transarterial chemoembolization) lub termoablacja guza. Rzadziej wykorzystuje się zaś jego alkoholizację. Francuscy badacze opisali zastosowanie TACE w okresie poprzedzającym przeszczepienie u biorców z HCC do 3 ognisk o średnicy <5 cm, bez cech inwazji naczyniowej. Roczne przeżycie chorych wynosiło 91%, a 2-letnie – 84%. Ponadto wykazano, że chemoembolizacja powodowała zmniejszenie średnicy guza o co najmniej 50% i wydłużała okres wolny od wznowy nowotworu po przeszczepieniu. Zachęca to do stosowania TACE jako przedtransplantacyjnej terapii pomostowej.
Skrócenie czasu oczekiwania na transplantację można osiągnąć przez poszerzenie puli narządów dzięki zastosowaniu graftów pochodzących z podziału wątroby („split”) lub pozyskiwanych od żywych dawców. Szczególną grupę dawców stanowią pacjenci z rzadkimi wrodzonymi chorobami metabolicznymi, których wątroba może być użyta do przeszczepienia, a oni sami otrzymują narząd od zmarłego dawcy. Tę technikę, zwaną techniką domino (DLT – domino liver transplantation; ryc. 6), po raz pierwszy zastosowano w Portugalii w 1995 roku. Racjonalne przesłanki przemawiające za takim postępowaniem dotyczą tego, że wątroba z przewlekłą chorobą metaboliczną morfologicznie jest prawidłowa, tylko produkuje nieprawidłowe białka, których działanie w organizmie biorcy ujawnia się zazwyczaj po minimum 15 latach od przeszczepienia. Dlatego pacjentów z rakiem wątrobowokomórkowym, a szczególnie osoby po 60 roku życia, kwalifikuje się w technice domino jako biorców. U takich chorych oczekiwana długość życia jest krótsza od czasu potrzebnego na ujawnienie choroby metabolicznej. Rodzinna polineuropatia amyloidowa (FAP – familial amyloid polyneuropathy), dziedziczona autosomalnie dominująco, stanowi główne wskazanie do leczenia przeszczepieniem.10 Zachęcające wyniki stosowania techniki domino u pacjentów z FAP skłoniły badaczy do rozszerzenia wskazań na inne rzadkie choroby metaboliczne, takie jak choroba syropu klonowego, rodzinna hipercholesterolemia czy nawet hemochromatoza.11
W Europie prym pod względem wykorzystania techniki domino wiedzie Portugalia, gdzie do 2015 roku odnotowano ponad 500 przypadków przeszczepień. Zaraz po niej plasuje się Francja – 173 chorych. Od 1999 roku prowadzony jest światowy rejestr przeszczepów wątroby w technice domino (DLTR – Domino Liver World Transplant Register), a szczegółowe aktualne dane są dostępne na stronie http://www.fapwtr.org.
Od czasu ustalenia kryteriów leczenia chorych z HCC dokonał się ogromny postęp. Mimo to kryteria kwalifikacji tych chorych do OLTx są jednym z koronnych tematów wielu publikacji oraz zjazdów transplantologicznych i hepatologicznych.
Techniki ablacji śródoperacyjnej
Termoablacja
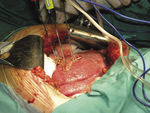
Termoablacja jest metodą leczenia nieresekcyjnych ogniskowych zmian nowotworowych wątroby z wykorzystaniem prądu o wysokiej częstotliwości. W terapii stosuje się prąd zmienny o częstotliwości 300-500 kHz (zazwyczaj około 460 kHz), który przepływając przez tkanki w bezpośrednim sąsiedztwie nieizolowanej elektrody, wywołuje gwałtowny ruch jonów i sprawia, że wytwarzają się znaczne ilości energii cieplnej. Zwiększenie temperatury żywej tkanki do 45-50°C powoduje jej odwodnienie i zagęszczenie, denaturację białek oraz destrukcję błon komórkowych. Termoablacja polega na dokładnym wprowadzeniu do wnętrza guza grubej igły zawierającej elektrodę i podłączeniu generatora prądu zmiennego. Czas i moc nastawia się zależnie od wielkości niszczonej zmiany. Obszar optymalny do termoablacji ma średnicę ≤3 cm. Zmieniając położenie elektrody, można niszczyć guzy o średnicy ≥6 cm. Termoablację wykonuje się pod kontrolą USG, a w niektórych ośrodkach stosuje się TK lub MR.10
Istnieje kilka sposobów na zwiększenie zasięgu termoablacji. Jeden z nich polega na zastosowaniu elektrod wiązkowych, np. zespolonej elektrody trzyigłowej. Jest to wiązka kilku elektrod we wspólnej osłonie, która pomaga przy ich wprowadzaniu do guza (ryc. 7). Po umieszczeniu w centrum zmiany elektrody wysuwają się w kształcie parasola, co powoduje zwiększenie zasięgu do 5 cm. Kolejnym sposobem jest chłodzenie elektrody. Temperatura jej końcówki podczas całego zabiegu nie przekracza 25°C, co zwiększa zakres działania i zapobiega karbonizacji otaczającej tkanki.11 Jeszcze inny sposób to podanie bezpośrednio do zmiany izo- lub hipertonicznego roztworu NaCl, który działa jak dodatkowy przewodnik prądu. Wykorzystanie pulsacyjnego wysyłania prądu przez generator także umożliwia powiększenie obszaru koagulacji. Zapobiega to nadmiernemu gromadzeniu się ciepła w strefie działania elektrody, a tym samym – wysuszaniu tkanek i zwiększaniu oporu.
Jeżeli planowane jest zniszczenie zmiany podczas jednego cyklu, elektrodę umieszcza się w jej centrum. Gdy rozmiar i kształt guza nakazują wykonać wielokrotną termoablację, elektrodę umieszcza się w miejscu najdalej położonym od głowicy USG, tak aby wytwarzane pęcherzyki gazu nie pogarszały obrazu ultrasonograficznego podczas zmiany pozycji elektrody. Po włączeniu aparatury proces ablacji trwa zazwyczaj 12 minut, po czym można wykonać ablację tego samego guza w innym miejscu lub innej zmiany (ryc. 8).