Kongres Akademii po Dyplomie Pediatria 2026 👉 200 zł taniej do 27.02. Spotkajmy się 17-18 kwietnia w Warszawie | Skorzystaj z oferty >
Czas trwania antybiotykoterapii
Podobnie jak w przypadku innych parametrów antybiotykoterapii, optymalny czas leczenia antybiotykiem jest w dużej mierze decyzją lekarza. Jest on uzależniony od rodzaju i ciężkości zakażenia oraz czynników związanych z pacjentem. Istnieją rekomendacje kliniczne dotyczące czasu trwania leczenia oraz informacje zawarte w ChPL. Stanowią one wiążące dane wynikające z analizy dostępnego piśmiennictwa. Należy mieć jednak świadomość, że w wielu przypadkach podane czasy leczenia są uważane za bezpieczne, czyli wystarczające do całkowitej eradykacji patogenów, nawet u osób z upośledzoną funkcją układu odpornościowego. W codziennej praktyce w wielu sytuacjach zalecana antybiotykoterapia może być zbyt długotrwała. W wielu publikacjach udowodniono, że modyfikacja czasu terapii (szczególnie jej skrócenie) na podstawie znaczącej poprawy klinicznej lub parametrycznej (saturacja tlenem, prokalcytonina), prowadzi do pełnego wyleczenia bez ryzyka nawrotu bądź powikłań21,22. W odniesieniu do wielu infekcji o niepowikłanym przebiegu, w tym szpitalnego zapalenia płuc albo odmiedniczkowego zapalenia nerek, przedłużanie terapii powyżej 7 dni nie przynosi dodatkowych korzyści23. Pomimo istniejącej wiedzy literaturowej w praktycznych przypadkach, w których codzienna obserwacja pacjenta nie jest możliwa, zaleca się czas leczenia zgodnie z ChPL.
Grupowy profil bezpieczeństwa antybiotyków
Najczęstsze objawy niepożądane związane z antybiotykoterapią dotyczą czynności przewodu pokarmowego oraz wystąpienia reakcji alergicznych. W skrajnych postaciach antybiotykoterapia w 28% przypadków stanowi przyczynę nagłych, zagrażających życiu martwiczych reakcji skórnych, takich jak zespół Stevensa-Johnsona oraz zespół toksycznej nekrolizy naskórka24.
Antybiotykoterapia nie jest obojętna wobec mikrobioty, czyli swoistego ekosystemu mikroorganizmów obecnych na skórze, w jelicie i w innych lokalizacjach u ludzi. Szacuje się, że łączna wielkość populacji drobnoustrojów zamieszkujących układ pokarmowy wynosi ok. 100 bilionów organizmów (przewyższając tym samym przybliżoną liczbę wszystkich komórek w ciele dorosłej osoby)25. Mikrobiota, w tym jelitowa, kształtuje się w sposób skoordynowany w pierwszych 2-3 latach życia. Bierze ona udział w regulacji odpowiedzi immunologicznej, dlatego pre- i postnatalne zaburzenia mikrobioty mogą zwiększać ryzyko rozwoju alergii oraz chorób autoimmunologicznych26.
Stosowanie antybiotyków może zaburzyć równowagę bakterii jelitowych i prowadzić do dysbiozy, czyli zachwiania bioróżnorodności. Stan ten charakteryzuje się obniżeniem liczby korzystnych dla organizmu bakterii, zwłaszcza z rodzaju Lactobacillus i Bifidobacterium, na rzecz mikroorganizmów patogennych, w tym m.in. gatunków Clostridioides difficile, Escherichia coli, Klebsiella pneumoniae, Salmonella enterica, czy Candida albicans27.Objawy dysbiozy często manifestują się już w trakcie antybiotykoterapii, ale mogą pojawić się nawet do 2 miesięcy od jej zakończenia, a wówczas rzadko kojarzone są z polekowymi działaniami niepożądanymi. Anthony i wsp. wykazali28, że wystarczy jeden cykl antybiotykoterapii trwający 5 dni, aby kompletnie przeorganizować ludzką mikrobiotę jelitową i wywołać zaburzenia żołądkowo-jelitowe. Częstość występowania biegunki poantybiotykowej u pacjentów ocenia się na 5-35%29. W przypadku 10-40% pacjentów objawy są łagodne i samoograniczające się, jednak nawet taki dyskomfort nierzadko skłania ludzi do przedwczesnego przerywania leczenia, co zwiększa ryzyko nawrotu infekcji bakteryjnych i rozwoju antybiotykooporności.
Badania wskazują, że różne antybiotyki generują odmienne wzorce zmian mikrobioty. Rodzaj zastosowanego preparatu, spektrum jego działania, schemat dawkowania, droga podania, farmakokinetyka, farmakodynamika oraz czas trwania cyklu leczenia mogą przekładać się na stopień uszkodzenia mikrobioty i ciężkość dysbiozy, a tym samym na tempo jej regeneracji. Zatem wybór konkretnego antybiotyku nie pozostaje bez znaczenia i wymaga należytej rozwagi (ryc. 1)28,30,31.
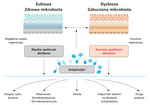
Rycina 1. Schemat przedstawiający różnice we wpływie antybiotyków na mikrobiotę jelitową. Im krótszy czas stosowania leku, mniejsza dawka, węższe spektrum działania antybiotyku, tym szybsza regeneracja mikrobioty jelitowej i odwrotnie
Obecne badania wskazują na znaczącą utratę bioróżnorodności mikrobioty pod wpływem działania określonych grup antybiotyków. Są one odpowiedzialne za obniżenie liczby bakterii należących do kluczowych taksonów32.
Wykazano, że dysbioza w wyniku terapii ampicyliną, amoksycyliną, klindamycyną, cefalosporynami trzeciej generacji (np. cefotaksym i ceftazydym) oraz fluorochinolonami zwiększa podatność pacjentów na reinfekcje lub infekcje patogenami oportunistycznymi33. Do takich patogenów należy C. difficile, w wyniku zakażenia tą bakterią zaburzenia żołądkowo-jelitowe mogą przybierać ciężką postać, taką jak rzekomobłoniaste zapalenie jelit, które jest związane z nadprodukcją toksyn bakteryjnych34,35 (tab. 1). Dodatkowymi czynnikami zwiększającymi ryzyko zakażenia C. difficile są m.in.: czas trwania antybiotykoterapii, liczba stosowanych leków, wiek podeszły pacjenta, obniżona odporność oraz hospitalizacja, zwłaszcza na oddziale intensywnej terapii (OIT)36. Ponadto antybiotyki o szerokim spektrum działania mogą prowadzić do nadmiernego namnażania drożdżaków C. albicans (tab. 1), które w normalnych warunkach nie stanowią zagrożenia, jednak u pacjentów z grup ryzyka (tj. osób z niedoborami immunologicznymi i cukrzycą) namnażają się w sposób niekontrolowany i stają się patogenne, prowadząc do rozwoju kandydozy narządowej np. przewodu pokarmowego czy układu rozrodczego.

Tabela 1. Najczęściej stosowane grupy antybiotyków oraz ich wpływ na układ pokarmowy i związane z tym działania niepożądane
Odbudowa równowagi ekosystemu drobnoustrojów jelitowych i uzyskanie stanu eubiozy stanowią duże wyzwanie dla organizmu28,32,38,39. Tempo i stopień regeneracji zależą od stopnia uszkodzenia mikrobioty oraz długości i rodzaju antybiotykoterapii. Ryzykiem klinicznym w okresie regeneracji po łagodnej dysbiozie jest podatność na choroby zakaźne bądź też możliwość pojawienia się przeciwciał przeciwko nowym bakteriom komensalnym zasiedlającym niszę jelitową, co może sprzyjać rozwojowi chorób autoimmunizacyjnych. Gdy natomiast zmiany mikrobioty pod wpływem antybiotykoterapii są zaawansowane i towarzyszą im zaburzenia funkcjonalne oraz metaboliczne, wtedy mikrobiota taksonomicznie przypomina mikrobiotę pacjentów hospitalizowanych w warunkach OIT. Wówczas szansa na pełny powrót do stanu wyjściowego jest niewielka, a zagrożenia z tym związane nie ustępują32,40,41. Tempo regeneracji mikrobioty jest silnie zindywidualizowane, a pacjenci z wyjściowo ubogim i mało zróżnicowanym mikrobiomem są bardziej narażeni na poważne i długotrwałe zaburzenia czynności układu pokarmowego po antybiotykoterapii w porównaniu z osobami o zróżnicowanym mikrobiomie. Dobra wyjściowa kondycja i skład mikrobioty jelitowej mogą chronić układ pokarmowy przed nadmiernym, szkodliwym wpływem antybiotykoterapii.
Zaburzenia mikrobioty jelitowej często dotyczą niemowląt oraz dzieci i w tej grupie wiekowej są szczególnie groźne. W badaniach Tanaka i wsp.42 oraz Fouhy i wsp.43 oceniano mikrobiotę niemowląt leczonych antybiotykami w pierwszym tygodniu oraz w drugim miesiącu życia. Wyniki tych badań wykazały, że wczesna ekspozycja niemowląt na antybiotyki skutkuje zmniejszeniem liczby bakterii z rodzaju Bifidobacterium na rzecz Proteobacterii. Ponadto dzieci otrzymujące antybiotyki częściej zapadały na infekcje bakteryjne44. Podobne zmiany zaobserwowano w przypadku mikrobioty niemowląt, których matki otrzymały antybiotyki przed porodem31. Śródporodowa profilaktyka antybiotykowa warunkuje odmienny skład mikrobioty potomstwa, który utrzymuje się przez pierwsze trzy miesiące życia i charakteryzuje się zwiększoną liczbą bakterii z rodzaju Enterococcus i Clostridium kosztem Bacteroides i Parabacteroides45. Dotychczas nie ustalono, czy okołoporodowe stosowanie antybiotyków i zmiany w mikrobiocie matki są przekazywane w sposób bezpośredni potomstwu, czy też pośredni, np. poprzez układ odpornościowy31. U dzieci, które były narażone na działanie antybiotyku w ciągu dwóch pierwszych lat życia zaobserwowano zwiększone ryzyko wystąpienia astmy, alergicznego nieżytu nosa, nadwagi, otyłości, zespołu nadpobudliwości psychoruchowej z deficytem uwagi (ADHD − attention deficit hyperactivity disorder) i trudności w nauce (tab. 2)46.
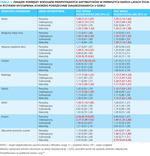
Tabela 2. Związek pomiędzy rodzajem przepisywanych antybiotyków w pierwszych dwóch latach życia a ryzykiem wystąpienia schorzeń powszechnie diagnozowanych u dzieci
Lepsze zrozumienie powikłań poantybiotykowych dotyczących mikrobioty dzieci oraz ustalenie związanego z nimi długotrwałego wpływu na życie dorosłe wymagają dalszych badań uzupełnionych o analizy rezystomu, metagenomu i metabolomu na różnych etapach życia47. Głównym celem przyszłych badań nad dysbiozą będzie uzyskanie mechanistycznego zrozumienia, w jaki sposób stosowanie antybiotyków m.in. u dzieci może zakłócać normalny rozwój ich mikrobioty jelitowej, a niekiedy całego układu odpornościowego, co z kolei może prowadzić do zwiększonego ryzyka rozwoju wielu chorób cywilizacyjnych. Dzięki dalszym badaniom możliwe będzie ustalenie praktycznych wytycznych klinicznych w celu optymalizacji korzyści i zminimalizowania ryzyka stosowania antybiotyków w populacji dziecięcej.
Antybiotykoterapia a zaburzenie funkcji układu immunologicznego
Stosowanie antybiotyków przynosi niekwestionowane korzyści dla zdrowia publicznego, umożliwiając leczenie chorych z infekcjami bakteryjnymi i zapobieganie ich poważnym konsekwencjom, włącznie ze śmiercią. Jednocześnie antybiotykoterapia może mieć szkodliwy wpływ na skład mikrobioty, co zostało opisane powyżej. Z kolei dysbioza może prowadzić do konsekwencji w różnych aspektach, w tym dla układu odpornościowego. Wynika to z interakcji pomiędzy mikroorganizmami i wydzielanymi przez nie substancjami a różnymi typami komórek immunologicznych (ryc. 2). Największa liczba tych komórek znajduje się w miejscach najliczniej zasiedlanych przez mikrobiotę, takich jak skóra i przewód pokarmowy48.