Tylko do 29 stycznia bilet na kongres Akademii po Dyplomie NEUROLOGIA kupisz w niższej cenie! Skorzystaj z oferty >
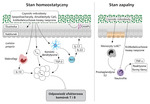
Rycina 2. Regulacja odpowiedzi immunologicznej przez mikrobiotę w stanie homeostazy polega na stymulowaniu limfocytów T regulatorowych poprzez produkty metabolizmu mikroorganizmów wykrywane przez komórki dendrytyczne, makrofagi i komórki T. Podczas stanu zapalnego mikroorganizmy odgrywają istotną rolę w nawigowaniu reakcjami komórek układu odpornościowego
Występowanie dysbiozy obserwuje się w różnych chorobach zapalnych i autoimmunologicznych, takich jak cukrzyca typu 1, celiakia, nieswoiste zapalenia jelit czy reumatoidalne zapalenie stawów (tab. 3). Dysbioza nie jest jedynie objawem tych chorób, ale również może pełnić rolę potencjalnego czynnika etiologicznego, prowadzącego do zmienionej odpowiedzi układu odpornościowego. Zaburzenie równowagi mikrobioty, spowodowane m.in. antybiotykoterapią, może także wpływać na podatność na infekcje poprzez zmiany funkcjonowania nieswoistej i swoistej odpowiedzi immunologicznej. Szczególnie wysokie ryzyko poważnych skutków antybiotykoterapii obserwuje się w grupie niemowląt i dzieci z uwagi na niedojrzałość zarówno układu odpornościowego, jak i mikrobioty jelitowej.
Wpływ antybiotyków na odpowiedź nieswoistą
Dysbioza wywołana terapią antybiotykami może wywierać istotny wpływ na sprawność mechanizmów nieswoistej odpowiedzi immunologicznej (ryc. 3)50. Po pierwsze, może przekładać się na ograniczoną aktywność komórek dendrytycznych, które są komórkami prezentującymi antygen i stanowią ogniwo łączące pomiędzy odpornością wrodzoną i nabytą60. Pod wpływem antybiotyków komórki dendrytyczne wykazują niekiedy zmniejszoną zdolność do indukowania ekspresji Foxp3 w naiwnych komórkach T, które są kluczowym czynnikiem transkrypcyjnym dla powstawania limfocytów T regulatorowych61. Po drugie, dysbioza wywołana antybiotykoterapią może prowadzić do zmniejszenia ekspresji czynników aktywujących komórki NK (natural killer) i ograniczać ich infiltrację do miejsca infekcji, a także upośledzać odpowiedź makrofagów na aktywujące je interferony typu I i II62. Po trzecie bywa, że dysbioza może negatywnie oddziaływać na nieswoiste komórki limfoidalne grupy C, ograniczając wydzielanie interleukiny 22. Ta cytokina odgrywa kluczową rolę w mechanizmach naprawczych nabłonka płuc i obronie przed patogenami63.
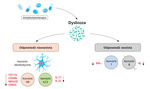
Rycina 3. Uogólnione mechanizmy wpływu antybiotyków na układ odpornościowy poprzez wywoływanie dysbiozy. W wyniku dysbiozy komórki odpowiedzi nieswoistej wykazują istotne zmiany fenotypowe i funkcjonalne. Dochodzi również do niedoborów funkcji efektorowych limfocytów T pomocniczych i cytotoksycznych oraz limfocytów B
Badania in vitro wskazują, że niektóre antybiotyki (chinolony, tetracykliny i makrolidy) w stężeniach występujących przy standardowym dawkowaniu mogą bezpośrednio wpływać na komórki układu immunologicznego i osłabiać nieswoiste mechanizmy odporności. Ten efekt został głównie powiązany z hamującym oddziaływaniem tych antybiotyków na szlaki sygnałowe transbłonowego receptora toll-podobnego 2 (TLR2) i toll-podobnego 4 (TLR4), które odgrywają kluczową rolę we wrodzonej odpowiedzi odpornościowej, chroniącej przed zakażeniem wirusowym i bakteryjnym62,64. W rezultacie wyhamowania ich działania pod wpływem antybiotyków dochodzi do ograniczonej aktywacji jądrowego czynnika transkrypcyjnego NF kappa B (NF-κB), produkcji interleukiny 6 (IL-6) i czynnika martwicy nowotworu α (TNF-α)64. Wykazano również, że ciprofloksacyna ograniczała zdolność makrofagów do fagocytozy64. Podobny efekt obserwowano w monocytach pod wpływem piperacyliny, doksycykliny lub moksyfloksacyny65. Z kolei chloramfenikol i erytromycyna ograniczały bakteriobójcze działanie wybranych peptydów przeciwdrobnoustrojowych, takich jak katelicydyny i piscydyny, oraz spowalniały zabijanie bakterii zależne od dopełniacza66. Z drugiej strony wykazano, że antybiotyki beta-laktamowe mają możliwość działania synergistycznego z kationowymi peptydami przeciwbakteryjnymi – do tego stopnia, że nafcylina i oksacylina mogą być z powodzeniem zastosowane jako wspomagająca terapia ratunkowa w celu skutecznego usunięcia gronkowca złocistego opornego na metycylinę (MRSA − methicyllin-resistant Staphylococcus aureus)67,68. Podobny synergizm z peptydami przeciwbakteryjnymi wykazano również dla ceftaroliny w zwalczaniu Streptococcus pneumoniae, ceftriaksonu w eliminowaniu Salmonella enterica oraz azytromycyny w zwalczaniu opornych na karbapenemy izolatów Pseudomonas aeruginosa, K. pneumoniae oraz Acinetobacter baumannii69-71.
Wpływ antybiotyków na odpowiedź swoistą
Z uwagi na interakcje pomiędzy gałęzią odporności wrodzonej a gałęzią odporności nabytej, negatywny wpływ antybiotyków na gałąź wrodzoną może potencjalnie prowadzić do upośledzenia funkcji gałęzi nabytej, zarówno w zakresie funkcji humoralnej, jak i komórkowej. Badania przeprowadzane z udziałem gryzoni wykazały, że dysbioza wywołana antybiotykoterapią, szczególnie we wczesnym okresie życia, prowadzi do znacznego upośledzenia odpowiedzi humoralnej wobec wielu różnych szczepień74-77. Obserwacje osób dorosłych, które otrzymywały szczepionkę przeciw grypie, również wskazują, że dysbioza powiązana z przyjmowaniem antybiotyków powoduje ograniczoną produkcję przeciwciał klasy IgA i IgG, zwłaszcza u osób charakteryzujących się niższym poziomem tych przeciwciał przed szczepieniem74. Wskazuje to na potencjalny negatywny wpływ antybiotykoterapii na tzw. odpowiedź wtórną związaną z przemianą komórek pamięci w komórki plazmatyczne. Ponadto niektóre antybiotyki z grupy chinolonów (np. moksyfloksacyna i ciprofloksacyna) mogą, w sposób zależny od dawki, zmniejszać produkcję interferonu-gamma (INF-γ) i interleukiny 4 (IL-4) przez limfocyty T pomocnicze (Th)62. Z kolei antybiotyki makrolidowe, np. klarytromycyna, mogą zmniejszać liczebność komórek Th2, co prowadzi do ograniczenia wydzielania IL-4 i zmiany stosunku limfocytów Th1do Th278,79.
Kliniczne skutki zaburzeń układu odpornościowego u dzieci powiązane z antybiotykoterapią
Z retrospektywnych badań kliniczno-kontrolnych wynika, że długoterminowe stosowanie antybiotyków wiązało się ze zwiększonym ryzykiem martwiczego zapalenia jelit i sepsy u niemowląt, zwłaszcza urodzonych przedwcześnie80-82. Ponadto wyniki przeprowadzonych metaanaliz wykazały, że stosowanie antybiotykoterapii w pierwszych 5 latach życia zwiększało ryzyko występowania astmy, atopowego zapalenia skóry (AZS), alergicznego nieżytu nosa i spojówek, alergii pokarmowych i łuszczycy, u podłoży których leżą dysfunkcje układu immunologicznego83. Z badań kliniczno-kontrolnych wynika również, że podanie antybiotyku matce w okresie okołoporodowym (na ogół w celu zapobieżenia wertykalnej transmisji paciorkowców z grupy B) wiązało się z istotnym wzrostem ryzyka wystąpienia poważnych infekcji bakteryjnych u niemowląt, które dodatkowo charakteryzowały się opornością na część antybiotyków z grupy aminopenicylin84. Dodatkowo, wyniki badań epidemiologicznych wskazują, że stosowanie antybiotyków przez matkę w okresie ciąży może zwiększać ryzyko wystąpienia infekcji w dzieciństwie, w tym infekcji dolnych i górnych dróg oddechowych, układu moczowego i pokarmowego, a także skóry85. Obserwacje te znajdują potwierdzenie w eksperymentalnych badaniach z udziałem zwierząt. Przykładowo, podawanie antybiotyków ciężarnym i karmiącym myszom prowadziło do istot nych zmian w składzie mikrobioty jelitowej ich młodych, ze znacznym wzrostem liczebności Enterococcus faecalis. Równocześnie obserwowano większą śmiertelność z powodu infekcji wirusem krowianki62. Wykazano także, że młode myszy, których matki narażone były na antybiotyki w czasie laktacji, charakteryzowały się w późniejszym okresie cięższym przebiegiem infekcji Citrobacter rodentium61. Narażenie ciężarnych zwierząt na antybiotyki (ampicylinę, gentamycynę, metronidazol, neomycynę i wankomycynę) zwiększało u ich potomstwa ryzyko sepsy wywołanej E. coli K1 i K. pneumoniae86. Wszystkie te obserwacje podkreślają, że rozwój niedojrzałej mikrobioty jelitowej może być istotnie zaburzony w wyniku stosowania antybiotyków, co pogłębia dysfunkcje nierozwiniętego w pełni układu odpornościowego, przekładając się na wzrost narażenia na infekcje bakteryjne i wirusowe oraz ich cięższe konsekwencje32,87.
Kliniczne skutki zaburzeń układu odpornościowego u dorosłych powiązane z antybiotykoterapią
Dowody z badań eksperymentalnych wskazują, że nadmierna, doprowadzająca do dysbiozy, ekspozycja na antybiotyki może wiązać się z dysfunkcją immunologiczną i w konsekwencji większą podatnością na infekcje, w tym również wirusowe88-92. Jednak o ile związek ten znajduje potwierdzenie w obserwacjach poczynionych w populacji dziecięcej, to w grupach osób dorosłych, zwłaszcza względnie zdrowych, nie był przedmiotem szczegółowych analiz epidemiologicznych. Pośrednio wskazują na to obserwacje, zgodnie z którymi stosowanie probiotyków u osób immunokompetentnych wiąże się z mniejszym nasileniem infekcji układu oddechowego. Z kolei u pacjentów z deficytami odporności, np. otrzymujących przeszczep komórek krwiotwórczych, stwierdzono, że zwiększone stosowanie antybiotyków wiązało się ze wzrostem ryzyka progresji infekcji wirusem paragrypy, metapneumowirusem i syncytialnym wirusem oddechowym (RSV − respiratory syncytial virus) do dolnych dróg oddechowych93.
Stosowanie antybiotyków może prowadzić do zaburzeń homeostazy mikrobioty organizmu ludzkiego, co z kolei może wpływać na mechanizmy regulacyjne nieswoistej i swoistej odpowiedzi immunologicznej. Dowody naukowe wskazują również, że w niektórych przypadkach antybiotyki wykazują bezpośrednie niekorzystne działanie wobec komórek biorących udział w odpowiedzi immunologicznej. Z jednej strony antybiotykoterapia niesie możliwość korzyści związanych z leczeniem infekcji bakteryjnych. Z drugiej strony jednak może negatywnie wpływać na funkcjonowanie układu odpornościowego, co prowadzi do zwiększonej podatności na zakażenia różnymi patogenami oraz podnosi ryzyko występowania chorób, których podłożem są dysfunkcje immunologiczne. W związku z tym istotne jest, by antybiotyki stosować wyłącznie w przypadkach potwierdzenia lub podejrzenia rozwoju infekcji bakteryjnej, a najlepiej po dokonaniu identyfikacji mikrobiologicznej. Jednocześnie należy pamiętać, że infekcje wirusowe występują zdecydowanie częściej niż bakteryjne. Nieuzasadniona klinicznie antybiotykoterapia może być w szczególności szkodliwa dla niemowląt i dzieci, z uwagi na niedojrzałość zarówno składu mikrobioty, jak i funkcji układu odpornościowego, a także dla pacjentów o zmniejszonej immunokompetentności. Nieuzasadnione i nadmierne stosowanie antybiotyków może również niekorzystnie wpływać na postnatalny rozwój układu odpornościowego i tym samym zwiększać podatność na występowanie chorób powiązanych z dysfunkcją mechanizmów odpowiedzi immunologicznej.
Antybiotyki – w dzieciństwie złe użycie, konsekwencja na całe życie
Antybiotyki należą do najczęstszych leków stosowanych w pediatrii94. Według szacunkowych danych, rocznie ponad 10% dzieci w Europie otrzymuje antybiotyk95. W Stanach Zjednoczonych recepty na antybiotyki stanowią 25% wszystkich recept wystawianych dla dzieci. Do najczęściej przepisywanych antybiotyków należą: amoksycylina, azytromycyna i amoksycylina z kwasem klawulanowym94. Według danych z innych krajów europejskich, ponad 2/3 dzieci otrzymuje antybiotyki jeszcze przed ukończeniem 2 r.ż. Średnio ponad połowa dzieci otrzymuje co najmniej jeden antybiotyk raz w roku, przy czym najwyższy wskaźnik stosowania przypada na 2 r.ż. W tym okresie mikrobiota jelitowa znajduje się na etapie kształtowania, co czyni ją najbardziej wrażliwą na działanie leków96-98. Przez lata główne obawy związane z nadmiernym stosowaniem antybiotyków skupione były na narastającym problemie antybiotykooporności. Jednak w ostatnich latach liczne dowody naukowe wskazują na kolejny problem − trwałą modyfikację ludzkiej mikrobioty jelitowej pod wpływem antybiotyków oraz jej długofalowe skutki zdrowotne. Istnieje wiele doniesień sugerujących, że antybiotyki mogą przyczyniać się do rozwoju niektórych nieinfekcyjnych chorób przewlekłych, szczególnie o podłożu immunologicznym, takich jak alergie, astma, zespół metaboliczny, otyłość, cukrzyca32,99, a także wielu schorzeń ośrodkowego układu nerwowego (OUN), w tym chorób neurodegeneracyjnych. Dodatkowo, wykazano związek pomiędzy nadmiernym używaniem antybiotyków a rozwojem zaburzeń psychiatrycznych – lęku i depresji100,101.